
下列说法正确的是( )
A.氘原子中的质子数和中子数之比为1∶1
B.Na2O2、Na2O中均只含离子键
C.NH4Cl属于离子化合物,不含共价键
D.18 g重水(D2O)中含有的电子数为10 NA
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2014年高考化学指导冲关 第9练非金属及其化合物练习卷(解析版) 题型:实验题
常温常压下,O3为淡蓝色有特殊臭味的气体,工业上常用O3作为造纸、纺织等行业的漂白和脱色剂,也可用作饮用水的消毒和杀菌剂,但O3浓度超标时会因其强氧化性而对人体产生毒副作用。自然条件下打雷时空气中会有部分O2转化为O3。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。
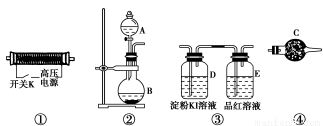
请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—)
B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:填空题
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①第ⅡA族元素的价电子数________。
②第三周期元素的最高正价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为_______________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________,B的化学式为________。
③工业上制取单质M的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:选择题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第3练化学反应与能量变化练习卷(解析版) 题型:选择题
已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第3练化学反应与能量变化练习卷(解析版) 题型:选择题
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )
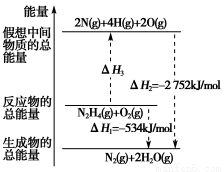
A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第2练氧化还原反应和离子反应练习卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32—+H2O
B.氯化钠与浓硫酸混合加热:H2SO4+2Cl-△,SO2↑+Cl2↑+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3— =3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42— 恰好完全沉淀:2Ba2++3OH-+Al3++2SO42— =2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第13练物质结构与性质练习卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最高价氧化物对应的水化物化学式为H2XO3 |
Y | Y是地壳中含量最高的元素 |
Z | Z的基态原子最外层电子排布式为3s23p1 |
W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)Z的第一电离能比W的________(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是________;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称________。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是________;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com