
【题目】25 ℃时,将某一元碱MOH和盐酸溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,则下列判断不正确的是
实验 序号 | c(盐酸)/ (mol·L-1) | c(MOH)/ (mol·L-1) | 反应后溶 液的pH |
甲 | 0.20 | 0.20 | 5 |
乙 | 0.10 | a | 7 |
A. 由实验甲可判断出MOH为弱碱 B. 将实验甲中所得溶液加水稀释后,c(H+)/c(M+)变小
C. a>0.10 D. MOH的电离平衡常数可以表示为Kb=10-8/(a-0.10)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯直接水合法制乙醇因污染小而应用于工业合成,下列有关说法错误的是( )
A. 该反应属于加成反应
B. 乙烯能使酸性KMnO4溶液褪色
C. 乙烷中含有少量乙烯,可用H2除去
D. 等物质的量的乙烯与乙醇充分燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示:下列说法正确的是:
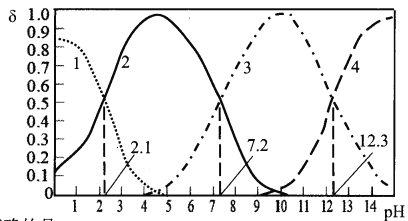
A. 曲线1和曲线2分别表示8(H3PO4)和6(HPO42-)的变化
B. 25℃时,H3PO4的电离常数K1=10-2.1
C. pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+)
D. pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:

回答下列问题:
(l)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是__________。
(2)先加入氨水调节pH =3,过滤,滤渣主要成分是_______;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为________。[己知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31]
(3)用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_______(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式_________。
=_______(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式_________。
(已知Kal(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5)
(4)草酸钪“灼烧”氧化的化学方程式为_____________。
(5)废酸中含钪量为15mg/L,V L废酸最多可提取Sc2O3的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是
A. CH4 + Cl2 ![]() CH3Cl + HCl B. CH2=CH2 + HBr → CH3CH2Br
CH3Cl + HCl B. CH2=CH2 + HBr → CH3CH2Br
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)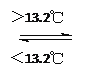 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
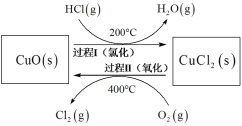
过程I的反应为:2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
①过程II反应的热化学方程式为_______。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______。
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
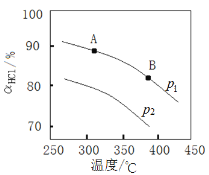
ⅰ.平衡常数比较:K(A)_____K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
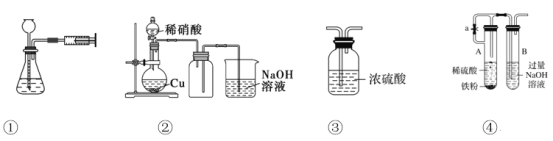
A. 用①所示的操作可检查装置的气密性
B. 用②所示的装置制取少量的NO
C. 用③所示的装置干燥H2、NH3、CO2等
D. 用④所示装置制取Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com