
| A.作调味剂 | B.用于食物防腐 | C.用于氯碱工业 | D.用于医疗 |
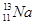 ② HClO4 OH– + H+ = H2O
② HClO4 OH– + H+ = H2O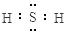 ④ ABCD
④ ABCD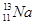 ;②上述五种元素中氯元素的非金属性最强,所以其最高价氧化物的水化物酸性最强,其化学式为:HClO4(高氯酸),高氯酸为强酸,与氢氧化钠溶液反应的离子方程式为:OH– + H+ = H2O;③X2M的电子式为H2S,其电子式见答案;④ZG是氯化钠,其用途广泛,可用作调味剂、食物防腐剂、氯碱工业的原料、用于医疗(生理盐水)等。
;②上述五种元素中氯元素的非金属性最强,所以其最高价氧化物的水化物酸性最强,其化学式为:HClO4(高氯酸),高氯酸为强酸,与氢氧化钠溶液反应的离子方程式为:OH– + H+ = H2O;③X2M的电子式为H2S,其电子式见答案;④ZG是氯化钠,其用途广泛,可用作调味剂、食物防腐剂、氯碱工业的原料、用于医疗(生理盐水)等。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:单选题
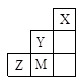
A.离子半径: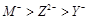 |
| B.Z元素形成的氧化物都是共价化合物 |
C.气态氢化物稳定性: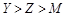 |
| D.三种元素中,M的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中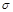 键与 键与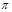 数目比为1:2 数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
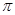 键数目为 。
键数目为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com