
【题目】下列方法中,不能用于实验室制备氨气的是
A. 加热浓氨水 B. 将浓氨水滴到生石灰上
C. 加热氯化铵固体 D. 将熟石灰和氯化铵的混合物加热
科目:高中化学 来源: 题型:
【题目】(1)在容积为1.00L的容器中,通入一定量的N2O4发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的△H_______0(填“大于”“小于”);
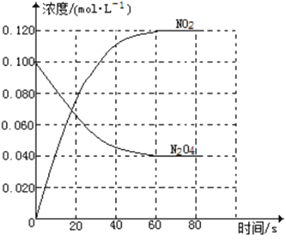
②100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_________molL-1s-1反应的平衡常数K为__________。
(2)在恒容密闭容器中通入X 并发生反应:2X(g) = Y(g);温度T1、T2下X的物质的最浓度c(X)随时间t 变化的曲线如图所示。
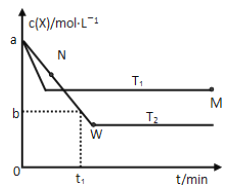
①T1____T2 (填“大于”或“小于”)。
②M点的正反应速率V正____N点的逆反应速率V逆(填“大于”,“小于”或“等于”)。
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s) + Br2(g) ΔH= + 105. 4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、SO42—、CO32—、HCO3—4种离子,若向其中加入少量过氧化钠固体后,溶液中离子浓度基本保持不变的是( )
A. HCO3— B. Na+ C. CO32— D. SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)基态As原子的核外电子排布式为[Ar]______,有________个未成对电子。
(2) As与N是同主族元素,从原子结构角度分析:为什么As的最高价含氧酸H3AsO4是三元酸(含三个轻基),而N的最高价含氧酸HNO3是一元酸(只含一个烃基)______。
(3)比较下列氢化物的熔点和沸点,分析其变化规律及原因__________。
(4) Na3AsO3中Na、As、O电负性由大至小的顺序是______。AsO33-的空间构型为___, AsO33-中As的杂化轨道类型为_______杂化。
(5)砷化稼(GaAs)为黑灰色固体,熔点为1238℃。该晶体属于___晶体,微粒之间存在的作用力是_________。
NH3 | PH3 | AsH3 | SbH3 | |
熔点/K | 195.3 | 140.5 | 156.1 | 185 |
沸点/K | 239.6 | 185.6 | 210.5 | 254.6 |
(6)图为GaAs的晶胞,原子半径相对大小是符合事实的,则白球代表____原子。
己知GaAs的密度为5.307g·cm3, Ga和As的相对原子质量分别为69.72、74.92,求晶胞参数a=______pm (列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹). 
(1)甲、乙两仪器的名称是、
(2)利用B装置可制取的气体有(写出两种即可).
(3)A、C、E相连后的装置可用于制取Cl2 , 写出A中发生反应的化学方程式
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验.
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 , 再打开止水夹 , 使烧杯中的水进入试管丁中.
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2 , 直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 molL﹣1(保留2位有效数值,气体按标准状况计算).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 三氧化硫溶于水能导电,所以它是电解质
B. 三氧化硫与氢氧化钡溶液、硝酸钡溶液都能反应生成沉淀
C. 三氧化硫能使石蕊试液先变红色,然后再变为无色
D. 硫粉在过量的纯氧气中燃烧生成三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知等浓度的NaX、NaY 、NaZ三种溶液的pH:10、9、8,则由此可判断下列叙述正确的是( )
A.HX > HY > HZB.HX < HY < HZ
C.HZ > HX > HYD.HX > HZ > HY
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com