
【题目】葡萄糖酸锌[Zn(C6H11O7)2]是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶于水,易溶于热水,不溶于乙醇。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
I.制备葡萄糖酸(C6H12O7):
60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温15 min。
II.制备葡萄糖酸钙[Ca(C6H11O7)2]:
将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
III.制备葡萄糖酸锌粗品(装置如右,夹持、控温装置略):

在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1) 步骤I中溴水的作用是作______,判断溴水略过量的现象是______。
(2) 步骤II中用CaCl2代替CaCO3可行吗?______ (填“可行”或“不可行”),乙醇可洗去葡萄糖酸钙固体表面杂质,还具有______、______优点。
(3) 步骤III中,恒压滴液漏斗需要打开活塞______ (填“a”、“b”或“a和b”),90℃下,葡萄糖酸钙与硫酸锌发生反应的离子方程式为______。
(4) 葡萄糖酸锌粗品含少量难溶于水的杂质,纯化晶体的合理操作顺序是______ (选填写正确序号)。
① 蒸发浓缩至溶液表面出现晶膜;② 待晶体充分析出后,减压过滤;③ 将滤液冷却至室温,加入10 mL 95%乙醇溶液并搅拌,促进晶体析出;④ 趁热减压过滤,除去不溶物;⑤ 在50℃下用恒温干燥箱烘干,称重;⑥ 取烧杯加入10 mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液。
(5) 测定产品纯度步骤如下:
取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于____中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,用c2mol·L-1 Zn2+标准溶液滴定至终点,发生反应:Zn2++EDTA2—=Zn-EDTA,三次滴定平均消耗锌标准溶液V2mL,则该产品的纯度为______%(保留1个数字系数)。
【答案】氧化葡萄糖变为葡萄糖酸 溶液出现微黄色 不可行 减少固体溶解损失 有利于快速干燥固体 b Ca2++ SO![]() =Ca SO4 ⑥④③②⑤ 锥形瓶
=Ca SO4 ⑥④③②⑤ 锥形瓶 ![]()
【解析】
(1) 葡萄糖是还原性糖,溴具有氧化性,反应后溶液为无色,而溴水为橙色,据此分析解答;
(2) 步骤II中将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生,目的是中和葡萄糖酸;根据物质的溶解性和乙醇的挥发性分析解答;
(3) 步骤III中葡萄糖酸钙与硫酸锌发生反应生成葡萄糖酸锌[Zn(C6H11O7)2]和硫酸钙,结合葡萄糖酸锌Zn(C6H11O7)2能溶于水,书写反应的离子方程式;
(4) 葡萄糖酸锌Zn(C6H11O7)2能溶于水,据此分析葡萄糖酸锌粗品含少量难溶性的杂质的步骤;
(5) 取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,发生反应Zn2++EDTA2- =Zn-EDTA,反应后剩余的Na2EDTA溶液再用c2mol·L-1 Zn2+标准溶液滴定至终点,据此分析计算。
(1) 葡萄糖是还原性糖,溴具有氧化性,步骤I中在60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温15 min,溴水可以氧化葡萄糖变为葡萄糖酸,溴水和葡萄糖反应后溶液为无色,而溴水为橙色,因此当看到溶液出现微黄色即可判断溴水已过量,故答案为:氧化葡萄糖变为葡萄糖酸;溶液出现微黄色;
(2) 步骤II中将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生,目的是中和葡萄糖酸,因此不能用CaCl2代替CaCO3;过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用,乙醇可洗去葡萄糖酸钙固体表面杂质,乙醇还具有减少固体溶解损失、有利于快速干燥固体等优点,故答案为:不可行;减少固体溶解损失;有利于快速干燥固体;
(3) 步骤III中,恒压滴液漏斗使用时,只需要打开活塞b;90℃下,葡萄糖酸钙与硫酸锌发生反应生成葡萄糖酸锌[Zn(C6H11O7)2]和硫酸钙,根据题意葡萄糖酸锌Zn(C6H11O7)2能溶于水,因此反应的离子方程式为Ca2++ SO![]() =Ca SO4,故答案为:b;Ca2++ SO
=Ca SO4,故答案为:b;Ca2++ SO![]() =Ca SO4;
=Ca SO4;
(4) 葡萄糖酸锌粗品含少量难溶于水的杂质,分离提纯葡萄糖酸锌晶体,需要取烧杯加入10 mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液;趁热减压过滤,除去不溶物;将滤液冷却至室温,加入10 mL 95%乙醇溶液并搅拌,促进晶体析出;待晶体充分析出后,减压过滤;在50℃下用恒温干燥箱烘干,称重;因此合理操作顺序为⑥④③②⑤,故答案为:⑥④③②⑤;
(5) 取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,用c2mol·L-1 Zn2+标准溶液滴定至终点,三次滴定平均消耗c2mol·L-1锌标准溶液V2mL,根据Zn2++EDTA2- =Zn-EDTA,则反应后剩余的EDTA2- 的物质的量为c2mol·L-1×V2L= c2V2×10-3mol,因此原mg提纯后的产品中含有Zn2+的物质的量为(c1V1×10-3mol -c2V2×10-3mol)×![]() ,即葡萄糖酸锌Zn(C6H11O7)2的物质的量为:4c1V1×10-3mol -4c2V2×10-3mol,则该产品的纯度为
,即葡萄糖酸锌Zn(C6H11O7)2的物质的量为:4c1V1×10-3mol -4c2V2×10-3mol,则该产品的纯度为![]() ×100%=
×100%=![]() %,故答案为:锥形瓶;
%,故答案为:锥形瓶;![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,一元弱碱甲胺(CH3NH2)的电离常数Kb≈4.0×10-4,lg5≈0.7。电解质溶液的电导率与离子浓度有关,电导率越大,溶液的导电能力越强。常温下,用0.02mol·L-1盐酸分别滴定20.00mL浓度均为0.02mol·L-1的NaOH溶液和CH3NH2溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列推断正确的是( )
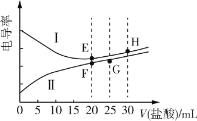
A.曲线Ⅰ代表NaOH的滴定曲线,H点对应的溶液中不存在电离平衡
B.G点对应的溶液中:c(Cl-)>c(H+)>c(CH3NH![]() )>c(OH-)
)>c(OH-)
C.常温下,E、F点对应的溶液中水电离的c(H+)水·c(OH-)水=1.0×10-14
D.常温下,F点对应的溶液的pH≈6.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:
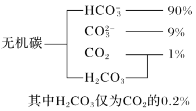
用离子方程式表示海水呈弱碱性的原因__。已知春季海水pH=8.1,预测夏季海水碱性将会__(填“增强”或“减弱”)
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是__(填字母)。
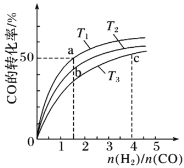
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
D.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
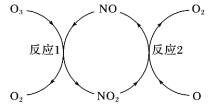
①NO的作用是__。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为__。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
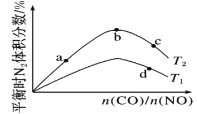
①b点时,平衡体系中C、N原子个数之比接近___。
②a、b、c三点CO的转化率从大到小的顺序为__;a、c、d三点的平衡常数从大到小的顺序为___。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___。
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应方向的说法,正确的是
A.同一物质的固、液、气三种状态的熵值递减
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都不可能自发
D.因为焓变和熵变都与反应的自发性有关,因此焓变或墒变均可以单独做为判断反应能否自发进行的判据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定溶液中大量共存的是
①无色溶液中:K+、Cl、Al3+、AlO2-、SO42-
②常温下,pH=14 的溶液中:CO32-、Na+、S2-、AlO2-
③室温下水电离的 c(H+)=10-13mol·L-1 的溶液:K+、HCO3-、Br-、Ba2+
④加入Al能放出H2的溶液中:NO3-、Cl-、Na+、SO42-
⑤中性溶液中:Cl-、NO3-、Na+、Fe3+
⑥室温下![]() =1012 的溶液中:Fe2+、Al3+、SO42-、I-.
=1012 的溶液中:Fe2+、Al3+、SO42-、I-.
A.①③⑥B.②④⑤C.②⑥D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯中盛有水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住使之平衡。小心向烧杯中滴加少量CuSO4溶液,反应一段时间。下列有关说法不正确的是
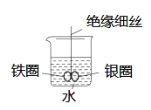
A.两圈摇摆不定
B.铁圈不断腐蚀
C.银圈上慢慢看到有红色物质覆盖
D.利用该原理,可以设计原电池装置,将化学能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com