
下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2 : 1 : 2
2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2 : 1 : 2
C. 升高温度,AgCl的溶解度增大,Ksp增大
D. FeCl3 、KAl(SO4)2、Na2CO3的水溶液均显酸性
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:填空题
(15分)研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;

(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知E为淡黄色固体,推断A-F各物
质时,下列说法正确的是:
A. C为碳酸氢钠。
B. E的俗称是硫磺。
C. B的俗称是苛性钠。
D. D代表水。

查看答案和解析>>
科目:高中化学 来源: 题型:
K2Cr2O7是一种常见的强氧化剂,酸性条件下会被还原剂还原成Cr3+。
(1)Cr3+能与OH-、CN-形成配合物[Cr(OH)4]-、[Cr(CN)6]3-。
① Cr3+的电子排布式可表示为________。
② [Cr(OH)4]-的结构式为(并标出配位键)________。
③ CN-与N2互为等电子体,写出CN-的电子式:________。
(2)K2Cr2O7能将乙醇氧化为乙醛,直至乙酸。
①乙醛中碳原子的杂化方式________、________。
②乙酸的沸点是117.9 ℃,甲酸甲酯的沸点是31.5 ℃,乙酸的沸点高于甲酸甲酯的沸点的主要原因是 。
(3)一种新型阳极材料LaCrO3的晶胞如图所示,已知距离每个Cr原子最近的原子有6个,则图中________原子代表的是Cr原子

查看答案和解析>>
科目:高中化学 来源: 题型:
实验报告中,以下数据合理的是
A.用碱式滴定管量取25.03mLH2SO4溶液
B.用50mL量筒量取21.48mL稀硫酸
C.用托盘天平称取11.7gNaCl
D.用pH试纸测定HNO3溶液的pH=3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是
A.氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2 = HCO3-
B.亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+ OH-= SO32-+ H2O
C.氯气通入冷水中 Cl2 +H2O = Cl- +ClO- +2H+
D.碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
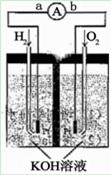
氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,
铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中
电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供
电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要
的储氢材料,吸氢和放氢原理如下:
2Li+H2 === 2LiH Ⅱ. LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率
为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为—890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=—890.3 kJ·mol—1
B.500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) 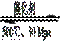 2NH3(g) △H=—38.6 kJ·mol—1
2NH3(g) △H=—38.6 kJ·mol—1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3- + Ba2+ + 2OH- = BaCO3↓+ CO32-+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com