
(1)研究硫及其化合物性质有重要意义。
 硫酸工业生产中涉及如下反应:
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g) 2SO3(g)。向2L的容器中充入
2SO3(g)。向2L的容器中充入
2molSO2、1molO2,SO2的平衡转化率与温度的关系
如右图所示。
T1温度时反应进行到状态D时,v(正) v(逆)
(填“>”、“<”或“=”)。
温度为T1时,反应的平衡常数K= 。(单位必须写)
若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍 b. Q2一定等于Q1
c. 新平衡时SO2的转化率一定大于80% d. T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a. KNO3溶液 b. AlCl3溶液 c. Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+ 浓度之比为 。
科目:高中化学 来源: 题型:
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是( )
A.②③ B.③⑥ C.①④ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1mol·L-1的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)
的值增大,可以采取的措施是 ( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
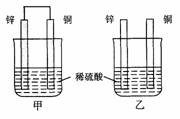
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温时,一固定容积的容器内发生如下反应:2NH3 (g)  N2 (g)+3H2 (g),达平衡后,再向容器内通入一定量的NH3(g),重新达到平衡后,与第一次平衡时相比,NH3的体积分数( )
N2 (g)+3H2 (g),达平衡后,再向容器内通入一定量的NH3(g),重新达到平衡后,与第一次平衡时相比,NH3的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol NH4+ 所含质子数为10NA
B.16克臭氧中所含原子数约为NA
C.1mol氯气被氢氧化钠溶液完全吸收,转移的电子数为2NA
D.标准状况下,44.8L水中所含的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含碘元素,有人设计如下步骤来提取碘:①加入6%H2O2溶液 ②将海带烧成
灰,向灰中加入蒸馏水 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液 ⑥加热煮沸
1~2分钟,合理的操作顺序为( )
A.②一⑥一④一①一③一⑤ B.②一①一⑥一③一④一⑤
C.②一①一③一⑥一⑤一④ D.②一③一①一⑥一⑤一④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
A. 2Na + 2H2O ==2NaOH + H2↑ B. CH4 + 2O2==CO2 + 2H2O
C. KClO3==2KCl + 3O2↑ D. CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的操作中,不能达到目的的是( )
A.除去苯中的少量溴:加入NaOH溶液后分液
B.除去乙烷中的少量乙烯:通入溴水中洗气
C.除去CO2中的少量HCl气体:通过盛有饱和NaHCO3溶液的洗气瓶
D.除去FeCl2溶液中的少量FeCl3:加入足量铜粉后过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com