
【题目】按要求填空
(1)操作一:在某压强恒定的密闭容器中加入2molN2和4molH2 , 发生如下反应:
N2(g)+3H2(g)2NH3(g);△H=﹣92.4kJ/mol
达到平衡时,体积为反应前的 ![]() .
.
求:达到平衡时,N2的转化率为 .
(2)操作二:若向该容器中加入a mol N2、b mol H2、c mol NH3 , 且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较操作一、操作二反应放出的能量:①②(>”、“<”或“=”).
(3)若将2molN2和4molH2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.试比较平衡时操作一、操作二NH3的浓度:①②(填“>”、“<”或“=”).
【答案】
(1)50%
(2)>
(3)>
【解析】解:(1.)体积之比等于物质的量之比,故平衡后反应混合气体总的物质的量为(2mol+4mol)× ![]() =4mol,则:
=4mol,则:
N2(g) | + | 3H2(g) | 2NH3(g) | 物质的量减少 | |
1 | 2 | ||||
n(N2) | 6mol﹣4mol=2mol |
故n(N2)=1mol,氮气的转化率= ![]() ×100%=50%,
×100%=50%,
所以答案是:50%;
(2.)开始加入a mol N2、b mol H2、c mol NH3 , 在相同条件下达到平衡时,混合物中各组分的物质的量与原平衡相同,为等效平衡,按化学计量数转化到左边满足氮气为2mol、氢气为4mol,(2)中由于氨气存在,故参加反应的氮气的物质的量比(1)中少,所以放出的热量①>②,
所以答案是:>;
(3.)若将2molN2和4molH2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡,等效为在Ⅰ平衡基础上增大体积降低压强,平衡时浓度混合气体浓度降低,平衡时NH3的浓度:①>②,
所以答案是:>.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: ①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时, , 可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是
A.若记录读数时,起始时仰视,终点时俯视
B.滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C.若配制硫酸时,定容时俯视刻度,其他操作正常
D.酸式滴定管在装酸液前未用待测硫酸溶液润洗
E.开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:(填序号)
(4)根据下列数据:
滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.45 |
第二次 | 20.00 | 4.00 | 29.05 |
第三次 | 20.00 | 3.00 | 30.00 |
第四次 | 20.00 | 2.00 | 27.00 |
请计算待测烧碱溶液的浓度为mol/L.
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为 . (假定杂质不参加反应,已知:①Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,I2+2S2O32﹣=2I﹣+S4O62﹣;②(NH4)2Cr2O7的摩尔质量为252g/moL).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应:mA(g)+nB(g)cC(g)+dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是( ) 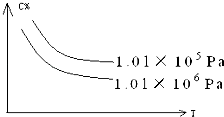
A.△H<0△S>0
B.△H>0△S<0
C.△H>0△S>0
D.△H<0△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2 . 测得有机化合物A的蒸气与H2的相对密度是30,求: 
(1)有机物A的分子式 .
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρg/cm3)的有机物A与足量钠完全反应后,量筒液面读数为bmL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为(可以不化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,正确的是 ( )
A.利用丁达尔现象区别NaCl溶液和K2SO4溶液
B.用渗析的方法除去胶体中的离子或分子,以净化胶体
C.用滤纸过滤除去溶液中的胶体粒子
D.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH) 3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属在生产生活中起着重要作用。
(1)下列金属制品中,利用金属导热性的是________(填字母)。
A. 金属硬币 B. 铝制导线 C. 铜制火锅
(2)金属钯是稀有的贵重金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。

①把钯戒指放入稀硫酸溶液中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之________(填“前”或“后”)。
②如图所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化。通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为__________。
③如果将钯粉置于盐酸溶液中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学电源的说法正确的是( )
A. 干电池放电之后还能再充电
B. 充电电池在放电和充电时都将化学能转化为电能
C. 充电电池可以无限制地反复放电、充电
D. 氢氧燃料电池是一种环境友好型电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com