
【题目】已知体积为2L的恒容密闭容器中发生反应:2SO2(g) + O2(g) ![]() 2SO3(g),请根据化学反应的有关原理同答下列问题:
2SO3(g),请根据化学反应的有关原理同答下列问题:
(1)一定条件下,充入2molSO2(g)和2molO2(g),20 s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为____。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)____。
①v正(SO2)=2v逆(O2)②混合气体的密度不变③混合气体的平均相对分子质量不变④各气体的浓度都不再发生变化
(3)下图表示该反应的速率(v)随时间(t)的变化的关系。则下列不同时间段中,SO3的百分含量最高的是(_________)
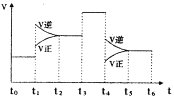
A、t2→t3) B、t0→t1 C、t5→t6 D、t3→t4
据图你认为t3时改变的外界条件可能是_____;t6时保持体积不变向体系中充人少量SO3,再次平衡后SO2的体积百分含量比t6时____(填“大”“小”或“等于”)。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 molSO3(g),关闭K,向B容器中充入2 molSO3(g),两容器分别发生反应。已知起始时容器A和B的体积均为aL。试回答:
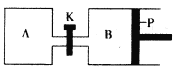
①反应达到平衡时容器B的体积为1.2aL,容器B中SO3转化率为____。
②若打开K,一段时间后重新达到平衡,容器B的体积为_____L(连通管中气体体积忽略不计,且不考虑温度的影响)。
【答案】0.04mol/(Ls) ③④ B 加入催化剂 小 40% 2.6a
【解析】
(1)设二氧化硫的转化率为x,则
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
开始![]() :2mol 2mol 0
:2mol 2mol 0
开始![]() :2xmol xmol 2xmol
:2xmol xmol 2xmol
平衡![]() :(2-2x)mol (2-x)mol 2xmol
:(2-2x)mol (2-x)mol 2xmol
20s后,测得SO2的体积百分含量为12.5%,相同条件下,气体的体积分数等于物质的量分数,即:![]() ,解得x = 0.8,
,解得x = 0.8,
反应消耗的二氧化硫的物质的量为:2xmol = 2×0.8mol = 1.6mol,再求二氧化硫表示该反应在这20s内的反应速率。
(2)①v正(SO2)=2v逆(O2),一个正向,一个逆向,且速率等于计量系数,因此为平衡状态,故①正确;②混合气体的密度也是时刻不变的,因为反应前后都是气体,质量守恒,而且体积是固定的,故②错误;③该反应前后质量一定,但是正向是气体物质的量减小的方向,正向移动时相对分子质量增大,当不变就达到平衡,故③正确;④各气体的浓度不再变化时,说明正逆反应速率相等,达到了平衡状态,故④正确。
⑶A选项,t2→t3,在t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向着逆向移动,说明是升高了温度,三氧化硫的含量减小,小于t0→t1;B选项,t0→t1时反应达到了初始平衡状态;C选项,t5→t6,正逆反应速率都减小,正反应速率减小的更多,平衡向着逆向移动,说明是减小了压强,三氧化硫的含量减小,小于t3→t4;D选项,t3→t4,正逆反应速率都增大且相等,说明使用了催化剂,化学平衡不移动,三氧化硫的含量不变,与t2→t3相等;因此三氧化硫的含量最高的为t0→t1;故B正确。
t3时正逆反应速率都增大,且相等,说明使用了催化剂;t6时保持体积不变向体系中充入少量SO3,相当于增大了压强,达到平衡时二氧化硫转化率增大,二氧化硫的百分含量减小,所以再次平衡后SO2的体积百分含量比t6时减小。
⑷①反应达到平衡时容器B的体积为1.2aL,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量增加了0.4mol,设反应消耗了三氧化硫nmol,则
2SO3(g) ![]() 2SO2(g) + O2(g) Δn
2SO2(g) + O2(g) Δn
2mol 2mol 1mol 1mol
nmol 0.4mol
2mol:nmol = 1mol:0.4mol
解得n = 0.8mol,三氧化硫的转化率为:![]() 。
。
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:6mol:2mol=V:1.2a,V=3.6a,所以容器B的体积为:3.6a-a = 2.6a。
(1)设二氧化硫的转化率为x,则
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
开始![]() :2mol 2mol 0
:2mol 2mol 0
开始![]() :2xmol xmol 2xmol
:2xmol xmol 2xmol
平衡![]() :(2-2x)mol (2-x)mol 2xmol
:(2-2x)mol (2-x)mol 2xmol
20s后,测得SO2的体积百分含量为12.5%,相同条件下,气体的体积分数等于物质的量分数,即:![]() ,解得x = 0.8,
,解得x = 0.8,
反应消耗的二氧化硫的物质的量为:2xmol = 2×0.8mol = 1.6mol,二氧化硫表示该反应在这20s内的反应速率为:![]() ,故答案为:0.04molL-1s-1。
,故答案为:0.04molL-1s-1。
(2)①v正(SO2)=2v逆(O2),一个正向,一个逆向,且速率等于计量系数,因此为平衡状态,故①正确;②混合气体的密度也是时刻不变的,因为反应前后都是气体,质量守恒,而且体积是固定的,故②错误;③该反应前后质量一定,但是正向是气体物质的量减小的方向,正向移动时相对分子质量增大,当不变就达到平衡,故③正确;④各气体的浓度不再变化时,说明正逆反应速率相等,达到了平衡状态,故④正确;因此③④正确。
⑶A选项,t2→t3,在t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向着逆向移动,说明是升高了温度,三氧化硫的含量减小,小于t0→t1;B选项,t0→t1时反应达到了初始平衡状态;C选项,t5→t6,正逆反应速率都减小,正反应速率减小的更多,平衡向着逆向移动,说明是减小了压强,三氧化硫的含量减小,小于t3→t4;D选项,t3→t4,正逆反应速率都增大且相等,说明使用了催化剂,化学平衡不移动,三氧化硫的含量不变,与t2→t3相等;因此三氧化硫的含量最高的为t0→t1;故B正确。
t3时正逆反应速率都增大,且相等,说明使用了催化剂;t6时保持体积不变向体系中充入少量SO3,相当于增大了压强,达到平衡时二氧化硫转化率增大,二氧化硫的百分含量减小,所以再次平衡后SO2的体积百分含量比t6时减小;故答案为:B;加入催化剂;小;
⑷①反应达到平衡时容器B的体积为1.2aL,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量增加了0.4mol,设反应消耗了三氧化硫nmol,则
2SO3(g) ![]() 2SO2(g) + O2(g) Δn
2SO2(g) + O2(g) Δn
2mol 2mol 1mol 1mol
nmol 0.4mol
2mol:nmol = 1mol:0.4mol
解得n = 0.8mol,三氧化硫的转化率为:![]() ,故答案为:40%。
,故答案为:40%。
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:6mol:2mol=V:1.2a,V=3.6a,所以容器B的体积为:3.6a-a = 2.6a,故答案为:2.6a。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某实验小组为探究![]() 漂白性的原因进行如下实验。已知
漂白性的原因进行如下实验。已知![]() 易溶于水,能溶于乙醇。
易溶于水,能溶于乙醇。![]() 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
![]()
![]() ;
;
![]()
![]() 。
。
实验室用亚硫酸钠粉末与硫酸制取![]() ,装置如图
,装置如图![]() 气密性良好
气密性良好![]() 。
。

(1)盛装![]() 的硫酸的仪器名称是________。使用
的硫酸的仪器名称是________。使用![]() 的硫酸比用
的硫酸比用![]() 的硫酸反应效果好,其原因是________。装置B的作用是________。
的硫酸反应效果好,其原因是________。装置B的作用是________。
(2)第一次实验:
C装置中混合溶液 | 品红的水溶液 | 品红的乙醇溶液 |
实验现象 | 红色褪去 | 无变化 |
从上述实验可知使品红水溶液褪色的微粒可能为________![]() 写出两种即可
写出两种即可![]() 。
。
(3)实验小组为进一步探究![]() 是使品红水溶液褪色的原因之一,进行第二次实验:取与第一次实验等体积等浓度的品红水溶液于装置C中,再加入少量NaOH固体,品红水溶液无明显变化,然后通入
是使品红水溶液褪色的原因之一,进行第二次实验:取与第一次实验等体积等浓度的品红水溶液于装置C中,再加入少量NaOH固体,品红水溶液无明显变化,然后通入![]() 气体,C装置中品红水溶液褪色。以上实验______
气体,C装置中品红水溶液褪色。以上实验______![]() 填“能“或“不能”
填“能“或“不能”![]() 证明
证明![]() 是使品红溶液褪色的原因之一,试用离子方程式说明理由:________。
是使品红溶液褪色的原因之一,试用离子方程式说明理由:________。
(4)请你设计探究![]() 是使品红水溶液褪色的原因之一的实验方案:________。
是使品红水溶液褪色的原因之一的实验方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
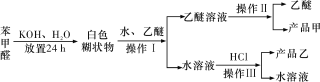
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
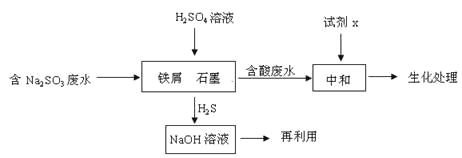
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或电离方程式中,不能正确表达反应颜色变化的是
A.将氨气通入滴有酚酞试液的水中,溶液变红:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
B.少量FeCl3溶液滴入沸水中变为红褐色液体:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C.向CuCl2溶液中加入足量的铁粉,溶液由蓝色变为浅绿色:Fe+CuCl2=Cu+FeCl2
D.呼吸面具使用后,Na2O2由淡黄色逐渐变为白色:2Na2O2=2Na2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com