
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
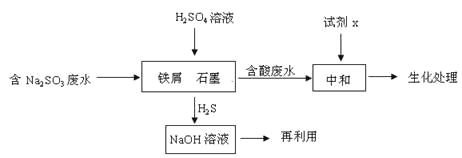
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
【答案】S2-+ H2O![]() HS-+ OH- 1:2 > 石灰水 H2S + 2NaOH = Na2S + 2H2O SO32-+ 8H+ + 6e-= H2S↑+ 3H2O 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= -1172.4kJ/mol
HS-+ OH- 1:2 > 石灰水 H2S + 2NaOH = Na2S + 2H2O SO32-+ 8H+ + 6e-= H2S↑+ 3H2O 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= -1172.4kJ/mol
【解析】
(1)某制革厂含硫废水中主要含有的物质是Na2S,
①Na2S属于强碱弱酸盐,S2-水解使溶液呈碱性,水解的离子方程式表示为:S2-+ H2O![]() HS-+ OH-;
HS-+ OH-;
②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,根据得失电子守恒,还原剂与氧化剂的物质的量之比为1:2;温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热,即△H>0;
(2)①中和含酸废水工业常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O;
③SO32-在酸性条件下放电生成H2S的过程为得电子的还原反应,电极反应式为SO32-+8H++6e-=H2S↑+3H2O;
④已知:①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol,
②SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol,
利用盖斯定律将①-②×2可得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=(-632.8kJ/mol)-2×(+269.8kJ/mol)=-1172.4kJ/mol,所以热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol。


科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
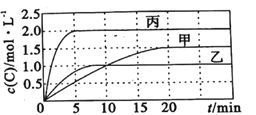
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种植物合成叶绿素的催化剂,也可用于制备多种含锰物质。
回答下列问题:
⑴工业上可用惰性电极电解MnSO4溶液的方法制备MnO2,其阳极的电极反应式为________。
⑵我国普遍采用两矿加酸法制备MnSO4。两矿指软锰矿(主要成分MnO2,含少量Al2O3和SiO2)、黄铁矿(FeS2)。生产MnSO4的工艺流程如下:
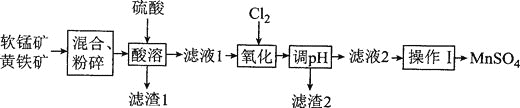
①软锰矿和黄铁矿需按一定比例混合,若黄铁矿过量太多,将导致的主要后果为________。
②“酸溶”时,黄铁矿被氧化为Fe3+、SO42-的离子方程式为________,该操作需控制在90℃,温度不能过低的原因为________。
③若使“氧化”的溶液中杂质离子除净,“调pH”应不小于________![]() 保留两位有效数字
保留两位有效数字![]() 。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
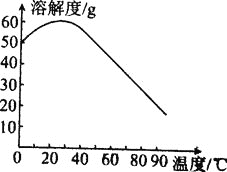
④MnSO4的溶解度曲线如图所示,则“操作I”,为________、________、用热水洗涤、干燥。
⑶用(NH4)2S2O8溶液鉴别溶液中Mn2+的现象为溶液变为紫红色。所发生反应中氧化剂和还原剂的物质的量之比为________。S2O82-中含有1个过氧键。则其中S元素的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知体积为2L的恒容密闭容器中发生反应:2SO2(g) + O2(g) ![]() 2SO3(g),请根据化学反应的有关原理同答下列问题:
2SO3(g),请根据化学反应的有关原理同答下列问题:
(1)一定条件下,充入2molSO2(g)和2molO2(g),20 s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为____。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)____。
①v正(SO2)=2v逆(O2)②混合气体的密度不变③混合气体的平均相对分子质量不变④各气体的浓度都不再发生变化
(3)下图表示该反应的速率(v)随时间(t)的变化的关系。则下列不同时间段中,SO3的百分含量最高的是(_________)
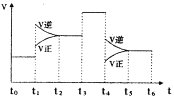
A、t2→t3) B、t0→t1 C、t5→t6 D、t3→t4
据图你认为t3时改变的外界条件可能是_____;t6时保持体积不变向体系中充人少量SO3,再次平衡后SO2的体积百分含量比t6时____(填“大”“小”或“等于”)。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 molSO3(g),关闭K,向B容器中充入2 molSO3(g),两容器分别发生反应。已知起始时容器A和B的体积均为aL。试回答:
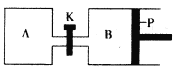
①反应达到平衡时容器B的体积为1.2aL,容器B中SO3转化率为____。
②若打开K,一段时间后重新达到平衡,容器B的体积为_____L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室从海带中提取碘的流程如下:
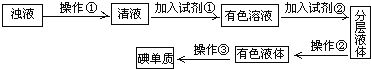
①指出过程中有关的实验操作①和②名称:①___,②___。
②下列物质中,能使湿润的KI-淀粉试纸变蓝的是___。
A.碘蒸气 B.Cl2 C.KI溶液 D.饱和氯化钠溶液
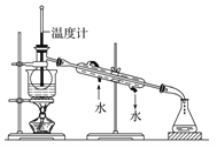
③有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如图蒸馏实验装置,此装置中的明显错误之处为____、____。
④试剂①若用H2O2溶液和稀硫酸,请写出发生反应的离子方程式___。
(2)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水VL加入0.50mol/LBa(OH)2溶液至不再产生沉淀时,恰好消耗40.00mLBa(OH)2溶液。请完成
①该酸雨pH随时间的增加而减小的原因是___(用化学方程式解释),
②若生成沉淀物的质量为4.50g,则沉淀物的组成为___(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )

A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
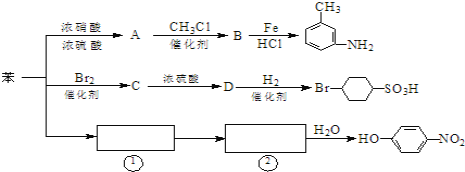
(1)A转化为B的化学方程式是____________________
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:①____,②_____
(3)有机物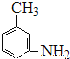 的所有原子___________(填“是”或“不是”)在同一平面上。
的所有原子___________(填“是”或“不是”)在同一平面上。
(4)有机物B苯环上的二氯代物有_____________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的恒容密闭容器中,某一反应中![]() 、
、![]() 、
、![]() 三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
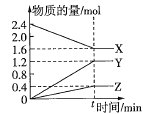
A.反应的化学方程式为![]()
B.t时刻,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则0~tmin内
,则0~tmin内![]() 的化学反应速率为
的化学反应速率为![]()
D.温度、体积不变,在tmin时充入![]()
![]() 使压强增大,正、逆反应速率都增大
使压强增大,正、逆反应速率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com