
【题目】一定温度下,在体积为2L的恒容密闭容器中,某一反应中![]() 、
、![]() 、
、![]() 三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
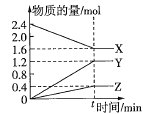
A.反应的化学方程式为![]()
B.t时刻,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则0~tmin内
,则0~tmin内![]() 的化学反应速率为
的化学反应速率为![]()
D.温度、体积不变,在tmin时充入![]()
![]() 使压强增大,正、逆反应速率都增大
使压强增大,正、逆反应速率都增大
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
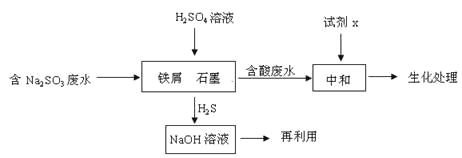
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,结构如图,下列说法正确的是( )
![]()
A.分子式为C3H6O3
B.分子中既有极性键也有非极性键
C.分子中σ键与π键个数之比为3:1
D.分子中碳原子的杂化方式全部为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的 是
)。下列说法错误的 是
A.肉桂醛和苯甲醛都能发生加成反应、取代反应
B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C.肉桂醛和苯甲醛互为同系物
D.肉桂醛和苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO,利用下图装置用正丁醇合成正丁醛。相关数据如下表:下列说法中,不正确的是( )
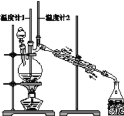
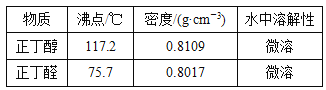
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
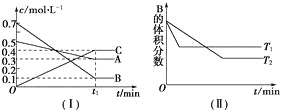
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________________________,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时,A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
④ 若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“正向”、“ 逆向”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,分别向
时,分别向![]() 的氨水、醋酸铵溶液中滴加
的氨水、醋酸铵溶液中滴加![]() 的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
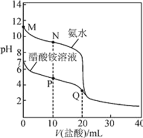
A.M点溶液中:![]()
B.N点溶液中:![]()
C.P点溶液中:![]()
D.Q点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系错误的是( )
A | NaCl=Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO HCO | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com