
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )

A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
【答案】C
【解析】
A. 实验c条件下,实验中60min到达平衡,恒温恒容下,利用压强之比等于物质的量之比计算平衡时混合气体总物质的量,再利用差量法代入公式计算得(0.2+0.2)mol×![]() =0.32mol,0.4mol-0.32mol=0.08mol,所以
=0.32mol,0.4mol-0.32mol=0.08mol,所以![]() ,A项正确;
,A项正确;
B.恒温恒容下,压强之比等于物质的量之比,实验a中平衡时混合气体总物质的量为(0.2+0.2)mol×![]() =0.3mol,这说明平衡时消耗反应物的物质的量和生成的生成物的物质的量均是0.4mol-0.3mol=0.1mol,剩余反应物均是0.2mol-0.1mol=0.1mol,容器容积为10L,则平衡常数K=
=0.3mol,这说明平衡时消耗反应物的物质的量和生成的生成物的物质的量均是0.4mol-0.3mol=0.1mol,剩余反应物均是0.2mol-0.1mol=0.1mol,容器容积为10L,则平衡常数K=![]() =
=![]() =100,B项正确;
=100,B项正确;
C. 根据c和a的反应判断,c起始压强较大,而投料量和容器的体积都没有变化,所以由公式PV=nRT来推断,是温度引起的,即c中温度高于a中温度,根据A和B可知c中反应物转化率低,说明升高温度,反应逆向进行,所以该反应为放热反应,C项错误;
D. 根据以上分析可知c中温度高,反应首先达到平衡状态,所以比较实验a、c可判断升高温度反应速率加快,D项正确;
答案选C。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
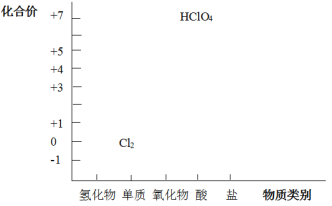
(1)根据图中信息,写出任意一种氯的氧化物的化学式_____。
(2)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的化学方程式_____________。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列说法不正确的是( )
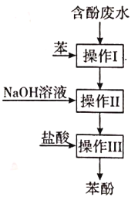
A. 操作Ⅰ为萃取,分液,萃取剂也可以用选用![]()
B. 苯酚钠在苯中的溶解度比在水中的小
C. 操作Ⅱ中得到的苯,可在操作Ⅰ中循环使用
D. 操作Ⅲ中要用蒸馏方法分离出苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质,将NaCl晶体溶于水,其溶解过程示意图如图所示,下列说法正确的是( )
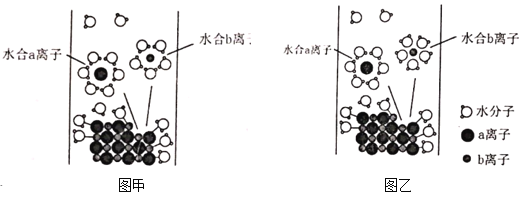
A.对比甲、乙两图,图甲中水合b离子的结构示意图不科学
B.图中a离子为![]() 、b离子为
、b离子为![]()
C.氯化钠晶体中存在离子键和分子间作用力
D.水分子对氯化钠晶体表面离子的作用不可能克服离子键的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是
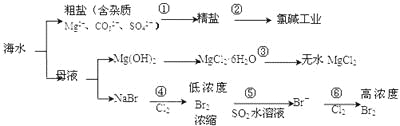
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.工业上通过电解饱和MgCl2溶液制取金属镁
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸多巴胺可用作选择性血管扩张药,是临床上常有的抗休克药。某研究小组按如下路线合成盐酸多巴胺。
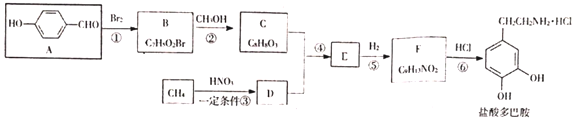
已知:
a.![]()
b.![]()
按要求回答下列问题:
(1)B的结构简式____。
(2)下列有关说法正确的是____。
A.有机物A能与![]() 溶液反应产生无色气体
溶液反应产生无色气体
B.反应①、②、③均为取代反应
C.有机物F既能与HCl反应,也能与NaOH反应
D.盐酸多巴胺的分子式为![]()
(3)盐酸多巴胺在水中的溶解性比多巴胺(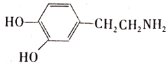 )强的原因是_____。
)强的原因是_____。
(4)写出多巴胺(分子式为![]() )同时符合下列条件的所有同分异构体的结构简式_____。
)同时符合下列条件的所有同分异构体的结构简式_____。
①分子中含有苯环,能使氯化铁溶液显色
②H–NMR谱和IR谱显示分子中有4种化学环境不同的氢原子,没有-N-O-键
(5)设计以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)_____。
的合成路线(用流程图表示,无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
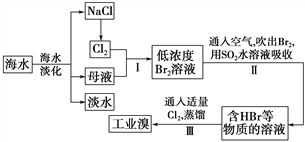
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
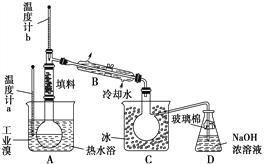
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
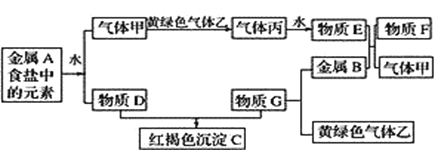
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com