
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是
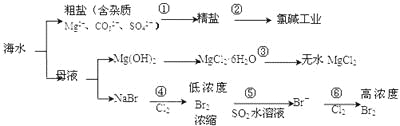
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.工业上通过电解饱和MgCl2溶液制取金属镁
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
【答案】D
【解析】
A.由于加入BaCl2溶液除去杂质SO42-时,为了将杂质离子除尽,加入的除杂试剂就要过量,为了除去过量的BaCl2溶液,还要再加入Na2CO3溶液,因此过程①加入的药品顺序Na2CO3溶液在BaCl2溶液之后加入,并且BaCO3、Mg(OH)2沉淀都能够溶于盐酸,所以应该先过滤,然后再加入盐酸酸化,所以加入药品的顺序可以为:BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸,错误;
B.MgCl2是强酸弱碱盐,若直接在过程③中将MgCl26H2O灼烧,盐发生水解反应产生Mg(OH)2,和HCl,HCl挥发,得到的固体Mg(OH)2灼烧分解产生MgO,因此不能制得无水MgCl2,错误;
C.工业上通过电解熔融MgCl2制取金属镁,错误;
D.溴与二氧化硫的水溶液反应生成氢溴酸和硫酸,故过程⑤反应后的溶液呈强酸性,会腐蚀金属设备,因此生产中需解决其对设备的腐蚀问题,正确。
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,电子排布式_____。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:____、____、____。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。____
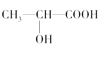
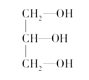
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)____。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4____H2SO3;HClO3____HClO4;H3PO4___H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
NH3中心原子的杂化方式为___杂化,VSEPR构型为__,分子的立体构型为____。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸乙酯是止痛止痒药物的重要成分,其结构简式如图。已知苯环上的氨基具有较强的还原性,下列关于该物质说法不正确的是( )
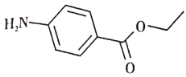
A. 核磁共振氢谱出现5组峰
B. 该物质应与酸、碱、氧化剂等分开存储
C. 该物质水解后有天然氨基酸生成
D. 该物质能发生加成、取代等多种反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )

A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
B.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
C.向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向明矾溶液中加入氢氧化钡溶液至SO42-恰好沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(Mole Day)这个时间的美式写法为6:02/10/23,外观与阿伏加德罗常数的值6.02×1023相似。用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L的![]() 和
和![]() 混合气体中含有的碳原子数为NA
混合气体中含有的碳原子数为NA
B.1 mol![]() 与过量的水蒸气完全反应时电子转移数为2NA
与过量的水蒸气完全反应时电子转移数为2NA
C.标准状况下,5.6L ![]() 含有的分子数为0.25NA
含有的分子数为0.25NA
D.1 mol/L ![]() 溶液中含有
溶液中含有![]() 的数目为2NA
的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学名称:A:_________I:_________J:_________G:_________
(2)写出C→I的离子方程式:_____________________________________________________。
(3)写出F→G实验现象:_________________________________________________________。
(4)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:

①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com