
【题目】每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(Mole Day)这个时间的美式写法为6:02/10/23,外观与阿伏加德罗常数的值6.02×1023相似。用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L的![]() 和
和![]() 混合气体中含有的碳原子数为NA
混合气体中含有的碳原子数为NA
B.1 mol![]() 与过量的水蒸气完全反应时电子转移数为2NA
与过量的水蒸气完全反应时电子转移数为2NA
C.标准状况下,5.6L ![]() 含有的分子数为0.25NA
含有的分子数为0.25NA
D.1 mol/L ![]() 溶液中含有
溶液中含有![]() 的数目为2NA
的数目为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是
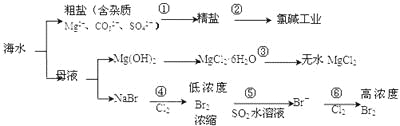
A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.工业上通过电解饱和MgCl2溶液制取金属镁
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
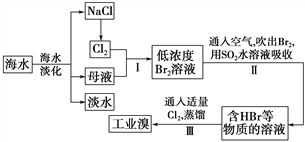
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
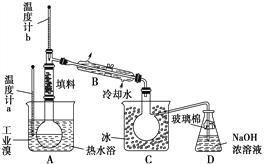
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料。
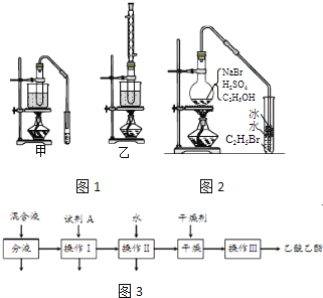
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______。
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是_____(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______。(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲、乙两套装置如图1都可以选用。关于这两套装置的说法正确的是______。(选填编号)

a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物。
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇。
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色。与方案①相比较,方案②的明显缺点是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01%B.0.09%C.1.0%D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
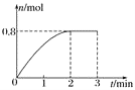
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如下图所示。
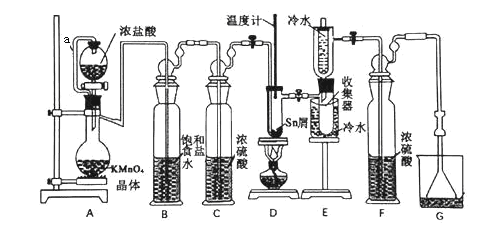
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4遇水极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是__________,装置A中发生反应的离子方程式为_____________ 。
(2)当观察到装置F液面上方出现______ 现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有两点:加快氯气与锡反应和_________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_______________________________。
(4)Cl2和Sn的反应产物有SnCl4和SnCl2,为了防止产品中带入过多的SnCl2,装置D可改为油浴加热来控制温度,该温度范围是________。
(5)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3===SnCl4+2FeCl2,再用0.1000 mol·L—1 K2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液 20.00 mL,则SnCl4产品的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com