
【题目】生产中常要控制化学反应条件增大反应速率.下列措施中不能加快化学反应速率的是( )
A.尽可能使用稀溶液
B.选择合适的催化剂
C.碾细固体反应物
D.提高反应体系的温度
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答: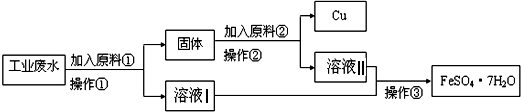
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,小明设计了如图所示的实验装置,按要求填空。

①请根据小明的意图,连接相应的装置,接口顺序: 接 , 接 , 接 。(填字母)____________
②U形管中所盛试剂的化学式为_____________;
③装置C中CCl4的作用是__________________;
④小红认为小明的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,小红同学提出在某两个装置之间再加装置F。你认为装置F应加在____之间(填装置序号)。瓶中可以放入_______;
⑤小强看到小明设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成________,如果观察到________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,B为黑色磁性氧化物, E为常见的强碱。

(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
【答案】 Al2O3 2Al+2OH—+2H2O=2AlO![]() +3H2↑ 2Fe2++Cl2=2Fe3++2Cl-
+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- ![]()
【解析】M为气体单质,且M能使带火星的木条复燃,则M为O2;D可作耐高温材料,则D可能为高熔点的Al2O3或MgO;B为黑色磁性氧化物,则B为Fe3O4。“A+B→C+D”,A、C为单质,B、D为金属氧化物,则该反应为高温条件下金属间的置换反应,则A、C为金属单质,B为Fe3O4,可知C为Fe;E为强碱,A为金属单质,A与E反应生成气体单质G,所以A为两性金属Al,D为Al2O3,G为H2。“G+K→L”,G为H2,K为气体单质,L+B(Fe3O4)→F+H,又“F+E(强碱)→I”,则可推测F中含有铁的阳离子,与强碱反应生成沉淀;逆推L应为酸,两种单质化合得到的酸,则K为Cl2,L为HCl;Fe3O4溶于盐酸生成FeCl2和FeCl3;根据F+K(Cl2)→H,可得F为FeCl2,H为FeCl3;沉淀I+M(O2)→J,则沉淀I为Fe(OH)2,J为Fe(OH)3。
(1)根据上述分析,D为Al2O3;
(2)反应①为Al与强碱反应生成AlO2-和H2,离子方程式为2Al+2OH—+2H2O=2AlO2-+3H2↑;
(3)反应②为FeCl2+ Cl2→FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)反应③为Fe(OH)2被氧气氧化为Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;其中4mol Fe(OH)2失去4mol电子,氧气得电子,故单线桥可表示为:![]() 。
。
【题型】推断题
【结束】
24
【题目】海带中提取碘的一种流程如下:

(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。

(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) .
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) .
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系A ![]() B(在水溶液中进行),其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式;D的电子式 . 如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 , 由A转化为B的离子方程式为 .
B(在水溶液中进行),其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式;D的电子式 . 如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 , 由A转化为B的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物. 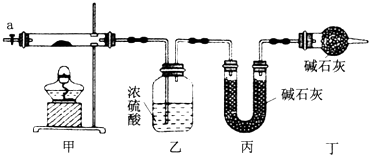
(1)按如图所示装置组装好仪器,并;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是 .
(2)某同学认为上述实验中存在一个缺陷,该缺陷是 .
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为 .
(4)CoCl26H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl26H2O的一种工艺如下: 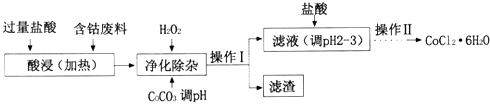
已知;25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为;
③加盐酸调整pH为2~3的目的为;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) | K(HClO) | K(H2CO3)a1=4.4×10﹣7 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )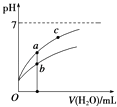
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)
B.图象中a、c两点所处的溶液中 ![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图象中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O=2HClO+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列热化学方程式
(1)使氯气和水蒸气通过灼热的炭层,生成氯化氢气体和二氧化碳气体是放热反应,当1mol氯气参与反应时释放145kJ的热量,写出热化学方程式:
(2)已知拆开1molH﹣H、1molN﹣H、1molN≡N分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式:
(3)炭粉与水蒸气反应生成CO(g)和标准状况下22.4LH2(g)吸收131.5kJ的热量,写出热化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com