
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,B为黑色磁性氧化物, E为常见的强碱。

(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
【答案】 Al2O3 2Al+2OH—+2H2O=2AlO![]() +3H2↑ 2Fe2++Cl2=2Fe3++2Cl-
+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- ![]()
【解析】M为气体单质,且M能使带火星的木条复燃,则M为O2;D可作耐高温材料,则D可能为高熔点的Al2O3或MgO;B为黑色磁性氧化物,则B为Fe3O4。“A+B→C+D”,A、C为单质,B、D为金属氧化物,则该反应为高温条件下金属间的置换反应,则A、C为金属单质,B为Fe3O4,可知C为Fe;E为强碱,A为金属单质,A与E反应生成气体单质G,所以A为两性金属Al,D为Al2O3,G为H2。“G+K→L”,G为H2,K为气体单质,L+B(Fe3O4)→F+H,又“F+E(强碱)→I”,则可推测F中含有铁的阳离子,与强碱反应生成沉淀;逆推L应为酸,两种单质化合得到的酸,则K为Cl2,L为HCl;Fe3O4溶于盐酸生成FeCl2和FeCl3;根据F+K(Cl2)→H,可得F为FeCl2,H为FeCl3;沉淀I+M(O2)→J,则沉淀I为Fe(OH)2,J为Fe(OH)3。
(1)根据上述分析,D为Al2O3;
(2)反应①为Al与强碱反应生成AlO2-和H2,离子方程式为2Al+2OH—+2H2O=2AlO2-+3H2↑;
(3)反应②为FeCl2+ Cl2→FeCl3,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)反应③为Fe(OH)2被氧气氧化为Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;其中4mol Fe(OH)2失去4mol电子,氧气得电子,故单线桥可表示为:![]() 。
。
【题型】推断题
【结束】
24
【题目】海带中提取碘的一种流程如下:

(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。

(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
【答案】 坩埚 将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤 3Ag+4H++NO![]() =3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
【解析】流程分析:海带中提碘的操作为,先灼烧海带,再水浸溶解,过滤除去不溶性杂质,得到含I-的溶液。加入硝酸银溶液沉淀I-,得到AgI沉淀,此为富集碘的过程。再向AgI固体中加入过量的铁和水,不断的搅拌,反应生成Ag单质固体和FeI2溶液,过滤,滤液为FeI2溶液,滤渣为Ag和未反应完的Fe。向滤液FeI2中通入Cl2,生成I2和FeCl3(或FeCl2);加入CCl4萃取,分液分离得到I2的CCl4溶液。
(1)图中A为坩埚;
(2)①滤渣中含有Fe和Ag,可以利用Fe和Ag的活泼性不同,用酸将二者分离。Fe与稀硫酸、盐酸反应,而Ag不反应,故可以用稀硫酸或盐酸分离Fe和Ag。具体操作为:将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤;
②Ag可以和稀硝酸反应生成AgNO3、NO和水,离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O;
(3)操作II为加入CCl4萃取,有机层为I2的CCl4溶液。CCl4的密度大于水,先将下层的有机溶液放入烧杯中,再将上层液体从上口倒出。具体操作为:打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中;
(4)可以利用KSCN检验溶液中是否含有Fe3+,具体操作为为:取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】依据反应原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,并利用下列装置制取碳酸氢钠粗品,实验装置正确且能达到实验目的是( )
A.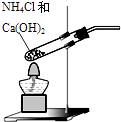
用装置制取氨气
B.
用装置制取二氧化碳
C.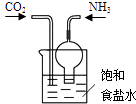
用装置制取碳酸氢钠
D.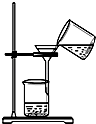
用装置分离碳酸氢钠与母液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 标准状况下,22.4LCCl4中含有的碳原子数为6.02×1023
B. 常温常压下,32gO3中含有的分子数为2×6.02×1023
C. 1mol·L-1Al2(SO4)3中含有的铝离子数为2×6.02×10 23
D. 2molCl2与足量NaOH完全反应,转移电子数为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2N2O4).
(1)硝酸在该反应中体现的性质有 .
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式 .
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是 , 如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 , 在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为mL;所得溶液(假设溶质不扩散)的物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g)反应中,已知v (HCN)=n mol/(Lmin),且v(O2)=m mol/(Lmin),则m与n的关系正确的是( )
A.m= ![]() n
n
B.m= ![]() n
n
C.m= ![]() n
n
D.m=2n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中常要控制化学反应条件增大反应速率.下列措施中不能加快化学反应速率的是( )
A.尽可能使用稀溶液
B.选择合适的催化剂
C.碾细固体反应物
D.提高反应体系的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)x M(g)+2N(g),5min后达到平衡生成1molN,经测定M的平均速率是0.1mol/(Lmin),下列叙述不正确的是( )
A.P的平均反应速率为0.15 mol/(Lmin)
B.Q的平衡浓度为1 mol/L
C.Q的转化率为25%
D.x等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是﹣285.8kJmlo﹣1﹣1411.0kJmlo﹣1和﹣1366.8kJmlo﹣1 , 则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.﹣44.2kJmol﹣1
B.+44.2kJmol﹣1
C.﹣330kJmol﹣1
D.+330kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com