
�������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ��������±���ʾ��
| Ԫ�� | �� | �� | �� | �� |
| ԭ�Ӱ뾶/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| ��Ҫ���ϼ� | +1 | +6��¯2 | +1 | ¯2 |
������������ȷ����
A�����ʵ��۵�ȱ����ʵ��۵��
B�����ʿ��õ���������εķ���ұ������
C�������£����������⻯���ΪҺ��
D���ҵļ�����������Ԫ�ظ����γɵļ������а뾶����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ��20mL 1 mol/L NaNO3��Һ��NO3-���ʵ���Ũ����ȵ��� �� ��
A��10 mL 1 mol/L Mg(NO3)2��Һ B��5 mL 0.8 mol/L Al(NO3)3��Һ
C��10 mL 2 mol/L AgNO3��Һ D��10 mL 0.5 mol/L Cu(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڣ�����Ȩ����־����ѧ�������˵¡�Ӣ��ѧ�����²ⶨ���������Ϊ45.27���ꡣ��ѧ�ҷ���������ʯ���٣�W��-182ͬλ�ص���������-182ͬλ����һ�������ɷ���������Hf��-182˥������ģ�����-182�ڵ���ѧ����˥��dz��졣��-182�������ܹ�������Ծ�ȷ���й���ʯ�������Ϣ������������Ϣ�������й�˵������ȷ���ǣ� ��
A��182 72Hf ��182 74W��Ϊͬλ�� B��182 74W ԭ�ӵ�������Ϊ182
C��182 74Wԭ�ӵ�������Ϊ108 D��182 74W ԭ�ӵĵ�����Ϊ74
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ������������������A��C��B��D�ֱ���ͬ����Ԫ�أ���֪B��D��Ԫ�ص�ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵�2����������Ԫ�صĵ��������������壬���ֹ��塣
��1��д��Ԫ�ط��ţ�A C
��2��д�����־�����A��B��C��D����Ԫ�صĻ�����������ݳ���������ӷ���ʽ��
��
��3���õ���ʽ��ʾ��A��B��C����Ԫ����ɵĻ�������γɹ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ṹΪ��-CH=CH-CH��CH-CH=CH-CH=CH-���ĸ߷��ӻ������õ������������䵼�����������ߡ������߷��ӻ�����ĵ�����
A����Ȳ B����ϩ C����ϩ D��1��3-����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��2H2(g) +O2(g) �� 2H2O(g) ��H =��483.6 kJ/mol


����˵������ȷ����
A���÷�Ӧԭ���������������ȼ�ϵ��
B���ƻ�1 mol H��O ����Ҫ��������463.4 kJ
C��H2O(g)��H2(g) + 1/2O2(g) ��H = +241.8 kJ/mol
D��H2(g) �е�H��H ���� H2O(g) �е�H��O ���ι�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ӦA��Cl2 + 2HBr == Br2 + 2HCl��
��������0.2 mol HCl����ʱ�ų�8.1 kJ��������
�����������仯ʾ��ͼ���£�
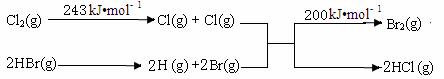
��ش�
��1���ڷ�ӦA���ƻ��Ļ�ѧ�������� ��
�� ���Լ� �� �Ǽ��Լ� �� ���Ӽ�
��2����ӦA���Ȼ�ѧ����ʽ�� ��
��3�����������ݿ�֪���Ͽ�1 mol H��Cl ����Ͽ� 1 mol H��Br�������������ԼΪ__________kJ��HCl��H��Cl ����HBr��H��Br��_________���ǿ��������������ԭ�ӽṹ�ǶȽ�����ԭ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йػ�ѧ�����ʾ��ȷ���ǣ� ��
A��������Ľṹʽ��H��Cl��O
B��������Ϊ53��������Ϊ72�ĵ�ԭ�ӣ�125 53I
C�����������ӵĽṹ��ʽ��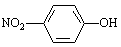
D��Na+�Ľṹʾ��ͼ��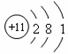
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����½�1g������C2H2�ڿ�������ȫȼ�գ�����CO2�����Һ̬ˮ���ų�akJ���������ʾC2H2ȼ���ȵ��Ȼ�ѧ����ʽΪ��_______________________
�ƣ���4�֣�����ƽ�����ʢ��ǿ��ԭ��Һ̬�£�N2H4����ǿ������Һ̬˫��ˮ�������ǻ�Ϸ�Ӧʱ��������������������ˮ���������ų��������ȡ���֪0.4molҺ̬����������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256KJ����������Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com