

分析 (1)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
②依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比;
(2)①根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题;
②依据热化学方程式,结合盖斯定律计算得到热化学方程式;
(3)防上锂与水发生氧化还原反应;阳极发生氧化反应,电极反应式为:4OH--4 e-=O2↑+2H2O.
解答 解:(1)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol,则写出的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
②1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3,故答案为:1:3;
(2)①由反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,A和B的能量之和大于C,由①A+B→X (△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C;X 的能量大于C,图象d符合,
故答案为:d:
②依据盖斯定律计算;
①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q3 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q1 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q3-Q2+3Q1)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q3-0.5Q2+1.5Q1 )KJ;
故答案为:0.5Q3-0.5Q2+1.5Q1;
(3)防上锂与水发生氧化还原反应;阳极发生氧化反应,电极反应式为:4OH--4 e-=O2↑+2H2O,故答案为:防止金属锂与水发生反应;4OH--4 e-=O2↑+2H2O.
点评 本题考查了燃烧热概念,热化学方程式的计算,盖斯定律的计算应用,物质的能量分析应用和化学反应的能量变化,热化学方程式的计算和盖斯定律的计算应用是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | |
| B. | 在BF3、PCl5中各元素的最外层都满足8电子稳定结构 | |
| C. | 溴化钙的电子式为:Ca2+[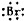 ]${\;}_{2}^{-}$ ]${\;}_{2}^{-}$ | |
| D. | 1molNa2O2中含有3NA个离子(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M分子中所有碳原子可能处在同一个平面上 | |
| B. | 1molM与浓溴水反应时最多消耗2molBr2 | |
| C. | M可以发生加成、加聚、氧化、还原、消去等反应 | |
| D. | M可以与Na、NaOH溶液、Na2CO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为氧化物,则Y也一定是氧化物 | |
| B. | 若M为金属单质,则N一定为金属单质 | |
| C. | 若X是不含金属元素的化合物,则N一定是非金属单质 | |
| D. | 若X是含有金属元素的化合物,则Y一定含有金属元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用浓硫酸干燥SO2气体 | |
| B. | 准确量取25.00 mL的液体可选用量筒或滴定管等量具 | |
| C. | 无色气体燃烧后生成的气体通入Ba(OH)2溶液,有白色沉淀生成,则原气体一定是CO | |
| D. | FeCl3、CuCl2的混合液中加铁粉充分反应后仍有固体存在,再加KSCN溶液可呈现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | Y 的非金属性比Q强,所以HnY的酸性比HnQ强 | |
| B. | ZX2、WX2的熔沸点、硬度相差很大,这是由于它们的化学键类型不同造成的 | |
| C. | W、Q、Y 元素的原子半径及其简单离子半径依次减小 | |
| D. | 将足量的 X 单质通入 W 的氢化物的水溶液,能得到 W 的低价氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-=40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 标况下,当有22.4LH2S参与反应时,有2mo1H+经质子膜进入负极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1molMgCl2 | B. | 3molKClO3 | C. | 1molAlCl3 | D. | 1.5molCaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com