
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯。甲烷在催化作用下脱氢,在不同温度下分别形成CH3、![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
物质 | 燃烧热(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式______。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)。该反应符合最理想的原子经济,则反应产物是______(填结构简式)。
(3)在一定条件下,向2L的恒容密闭反应器中充入1molCH4,发生上述(1)反应,10分钟后达到平衡,测得平衡混合气体中C2H4的体积分数为20.0%.则:
①用CH4表示该反应的平均速率为______。
②在该温度下,其平衡常数K=______。
③下列说法正确的是______。
a.升高温度有利于提高C2H4的产率
b.向平衡体系中充入少量He,CH4的转化率降低
c.当混合气体的密度不再变化时,说明该反应达到平衡状态
d.向上述平衡体系中再充入1molCH4,达到平衡后H2的体积分数减小
e.若实验测得:v(正)=k(正)c2(CH4),v(逆)=k(逆)c2(H2)c(C2H4)。其中k(正)、k(逆)为受温度影响的速率常数,该反应的平衡常数K=![]()
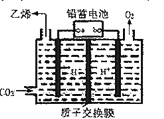
(4)以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。电解过程中,阳极区溶液中c(H+)逐渐______(填“增大”、“减小”或“不变”),阴极反应式______。
【答案】2CH4(g)═C2H4(g)+2H2(g) △H=+202.0kJ/mol ![]() 0.025mol·L-1·min-1 0.125 ae 增大 2CO2+12H++12e-=C2H4+4H2O
0.025mol·L-1·min-1 0.125 ae 增大 2CO2+12H++12e-=C2H4+4H2O
【解析】
(1)已知:①H2(g)+1/2O2(g)═H2O(l) △H1=285.8kJ/mol,
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2=890.3kJ/mol,
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H3=1411.0kJ/mol,
甲烷制备乙烯的化学方程式为:2CH4(g)═C2H4(g)+2H2(g),反应可由②×2③①×2得到,根据盖斯定律,反应的焓变为△H=2△H2△H32△H1=+202.0kJ/mol,故答案为:2CH4(g)═C2H4(g)+2H2(g) △H=+202.0 kJ/mol;
(2)用Ag作催化剂,可实现乙烯与氧气制备X(分子式C2H4O,不含双键),该反应符合最理想的原子经济,X为![]() ,方程式为
,方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)设平衡时生成的C2H4的物质的量为a,根据三段式:
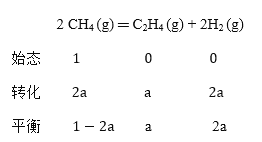
![]() ×100%=20.0%,a=0.25mol。
×100%=20.0%,a=0.25mol。
①用CH4表示该反应的平均速率为:v(CH4)= =0.025mol·L-1·min-1,故答案为:0.025mol·L-1·min-1;
=0.025mol·L-1·min-1,故答案为:0.025mol·L-1·min-1;
②在该温度下,其平衡常数K=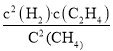 =
=![]() =0.125,故答案为:0.125
=0.125,故答案为:0.125
③a.2CH4(g)═C2H4(g)+2H2(g) △H=+202.0 kJ/mol,正反应为吸热反应,所以升高温度,平衡正向移动,有利于提高C2H4的产率,a正确;
b.恒容密闭反应器中,充入少量He,压强变大,但各物质的浓度不变,平衡不移动,CH4的转化率不变,b错误
c.总质量不变,总体积不变,密度也不变,当混合气体的密度不再变化时,不能说明该反应达到平衡状态,c错误;
d.向上述平衡体系中再充入1molCH4,建立等效平衡,达到平衡后H2的体积分数不变,d错误;
e. v(正)=k(正)c2(CH4),v(逆)=k(逆)c2(H2)·c(C2H4),该反应的平衡常K=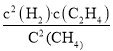 =
=![]() ,e正确;故答案为:ae;
,e正确;故答案为:ae;
(4)阴极反应式:2CO2+12H++12e-=C2H4+4H2O,阳极反应式:2H2O-4e-=4 H++O


科目:高中化学 来源: 题型:
【题目】碘化锂(![]() )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备![]() 和
和![]() ,流程如下:
,流程如下:
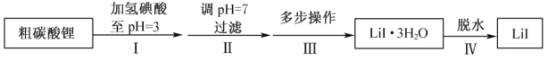
已知:![]() 在75~80℃转变成
在75~80℃转变成![]() ,80~120℃转变成
,80~120℃转变成![]() ,300℃以上转变成无水
,300℃以上转变成无水![]() 。
。
b.![]() 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c.![]() 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
(1)步骤II,调![]() ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的![]() 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得![]() 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得![]() 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得![]() 、
、![]() 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调![]() ,用滴定管中的
,用滴定管中的![]() 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的![]() 标准溶液体积计算,得
标准溶液体积计算,得![]() 、
、![]() 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。![]() 纯度偏低。
纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③![]() 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。

(4)步骤IV,采用改进的实验方案(装置如图),可以提高![]() 纯度。
纯度。
①设备X的名称是________。
②请说明采用该方案可以提高![]() 纯度的理由________。
纯度的理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银、铜和铅,工艺流程如图所示。

(1)步骤①当盐酸的浓度和KClO3的量一定时,写出两点可提高“浸取”速率的措施______;从Cu和Pb混合物中提取Cu的试剂为______(填名称)。
(2)步骤③反应的化学方程式为______。
(3)步骤④分离出的滤渣中主要含有两种杂质,为了回收滤渣中的非金属单质,某实验小组向滤渣中加入试剂______(填化学式),充分溶解后过滤,然后将滤液进行______(填操作名称),得到该固体非金属单质。
(4)步骤⑤反应中氧化剂和还原剂的物质的量之比为______。
(5)排放后的废水中含有NO3-,任意排放会造成水体污染,科技人员在碱性条件下用Al粉将NO3-还原成无污染气体排放,该方法的缺点是处理后的水中生成了AlO2-,依然对人类健康有害。该反应的离子方程式为:______。25℃时,欲将上述处理过的水中的c(AlO2-)降到1.0×10-7mol/L,此时水中c(Al3+)=______molL-1.(已知,25℃,Ksp(Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,电池总反应为M1-xFexPO4+LiC6![]() LiM1-xFexPO4+6C,其原理如图所示,下列说法正确的是( )
LiM1-xFexPO4+6C,其原理如图所示,下列说法正确的是( )
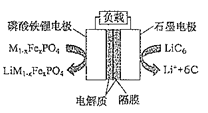
A.充电时,正极质量增加
B.放电时,电流由石墨电极流向磷酸铁锂电极
C.充电时,阴极反应式为Li++6C+e-═LiC6
D.放电时,Li+移向石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种常用于缓解哮喘等肺部疾病的新型药物,一种合成路线如图:
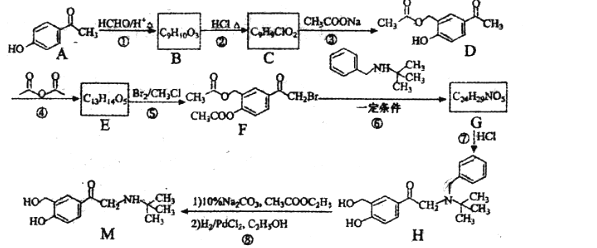
已知:RX+ ![]() +HX。请回答:
+HX。请回答:
(1)化合物D中官能团的名称为______。
(2)化合物C的结构简式为______。
(3)①和④的反应类型分别为______,______。
(4)反应⑥的化学方程式为______。
(5)下列说法正确的是______。
A.化合物B能发生消去反应
B.化合物H中两个苯环可能共平面
C.1mol 化合物F最多能与5mol NaOH反应
D.M的分子式为C13H19NO3
(6)同时符合下列条件的化合物A的同分异构体有______种(不包括立体异构),其中核磁共振氢谱有5组峰的结构简式为______。①能与FeCl3溶液发生显色反应②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下:

下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.元素乙的简单气态氢化物的稳定性强于CH4
C.原子半径比较:甲>乙>Si
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com