
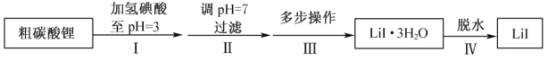
【题目】碘化锂(![]() )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备![]() 和
和![]() ,流程如下:
,流程如下:
已知:![]() 在75~80℃转变成
在75~80℃转变成![]() ,80~120℃转变成
,80~120℃转变成![]() ,300℃以上转变成无水
,300℃以上转变成无水![]() 。
。
b.![]() 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c.![]() 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
(1)步骤II,调![]() ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的![]() 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得![]() 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得![]() 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得![]() 、
、![]() 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调![]() ,用滴定管中的
,用滴定管中的![]() 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的![]() 标准溶液体积计算,得
标准溶液体积计算,得![]() 、
、![]() 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。![]() 纯度偏低。
纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③![]() 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。

(4)步骤IV,采用改进的实验方案(装置如图),可以提高![]() 纯度。
纯度。
①设备X的名称是________。
②请说明采用该方案可以提高![]() 纯度的理由________。
纯度的理由________。
【答案】![]() B AC d f c b
B AC d f c b ![]() 抽气泵 抽除空气,避免
抽气泵 抽除空气,避免![]() 被氧化,减压,有利脱水
被氧化,减压,有利脱水
【解析】
(1)碱性氧化物或碱都可以与酸反应,起到调节pH的作用;
(2)根据提供的![]() 的性质进行分析;
的性质进行分析;
(3)①润洗容量瓶会使浓度偏大;润洗锥形瓶消耗更多的待测液;
③![]() 在空气中加热易被氧化;
在空气中加热易被氧化;
(4)①![]() 在空气中加热易被氧化,需要将空气抽出;
在空气中加热易被氧化,需要将空气抽出;
②该方案抽出空气且瓶内压强较低,据此分析。
(1)将酸性溶液调节成中,又不引入新的杂质,可选用![]() 调节pH值;
调节pH值;
(2)A.用冰水浴快速冷却结晶得到的是较小颗粒的晶体,故A错误;
B.抽滤可以加快过滤速度,得到较干燥的晶体,故B正确;
C.![]() 易溶于水,溶解度随温度升高而增大,故C错误;
易溶于水,溶解度随温度升高而增大,故C错误;
D.![]() 在75~80℃转变成
在75~80℃转变成![]() ,80~120℃转变成
,80~120℃转变成![]() ,故D错误
,故D错误
(3)①润洗容量瓶会使浓度偏大;润洗锥形瓶消耗更多的待测液,测定的待测液浓度偏大;
②移液管的正确使用步骤为蒸馏水洗涤→待转移溶液润洗→洗耳球吸溶液至移液管标线以上,食指堵住管口→放液至凹液面最低处与移液管标线相切,按紧管口→移液管尖与锥形瓶内壁接触,松开食指放液设备→放液完毕,停留数秒,取出移液管→洗净,放回管架;
③![]() 在空气中受热易被氧化生成
在空气中受热易被氧化生成![]() ;
;
(4)①设备X的作用是将仪器内的空气抽出,其名称为抽气泵;
②该方案抽出空气且瓶内压强较低,抽除空气,避免![]() 被氧化,减压,有利脱水;
被氧化,减压,有利脱水;


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
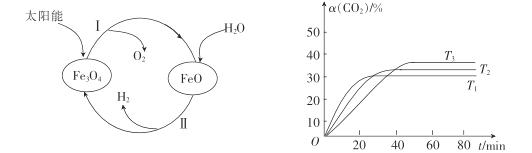
(1)以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如图所示。
已知:H2O(l)= H2(g)+![]() O2(g)△H1+285.5kJ·mol-1
O2(g)△H1+285.5kJ·mol-1
过程I:2 Fe3O4(s)6 FeO (s)+O2(g)△H2=+313.2kJmol-1
则过程II的热化学方程式为 ______________________________。
(2)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)△H <0,T℃ 时,在 1L 恒容密闭容器中加入Fe3O4、CO各0.5mol,5min反应达到平衡时,固体质量减小了6.4g。
①从起始到反应达到平衡时v(CO2)=______,T℃时,该反应的平衡常数K=________。
②欲提高该反应中 CO的平衡转化率,可采取的措施是______(任写一个即可)。
③其他条件不变时,该反应在不同温度下,CO2的产率随时间的变化α(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是____,判断依据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
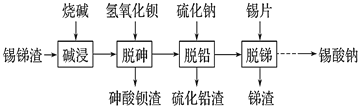
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
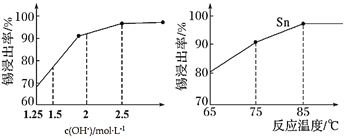
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:

查阅资料得知:
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.

回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。

Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:

(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与 0.5mol/LNa2CO3溶液的反应,实验如下。
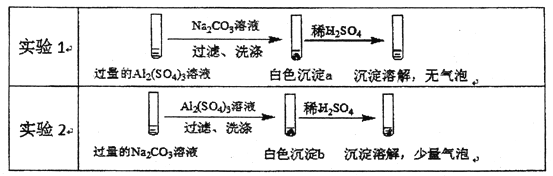
下列分析不正确的是
A. 实验1中,白色沉淀a是A1(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH有关
D. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式___。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是___。
向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐___(填“变大”、“变小”),生成的沉淀是___;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___。
a.c(Na+)=c(S2O32-) +2c(HSO3-)+2c(H2SO3) + 2c(HS-)
b.c(Na+)+c(H+)=2c(S2O32-)+c(HSO3-) +c(HS-) +c(OH-)
c.c(Na+)=2c(HS-)
d.c(Na+)=2c(HS-)+2c(S2O32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
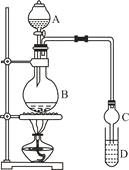
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是
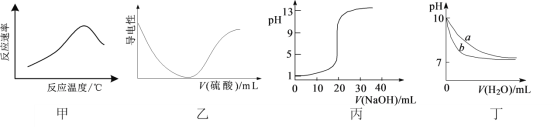
A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D.图丁表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含NO、CO2、NO2、NH3、N2中的几种。将100 mL气体甲经过下图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为
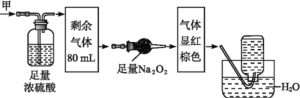
A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、COD.NO、CO2、N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com