
某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3.C.N2.AlN.CO
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目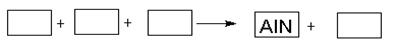
(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3  AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
(1) (4分)
(4分)
(2)(2分) 5.6 L (3)(2分)AB
解析试题分析:(1)由化合价升降法配平,C(0)→CO :C(+2) C升高2;N2:2N(0)→2AlN;2N(0)→ 2N(-3),N降低6 ,最小公倍数6,C和CO前填3 ;AlN前填2;其他观察法配平。电子由C
转移给N2, 共6e。
(2)设该反应产生气体的体积为x
3CO------------6e-
3*22.4 6*6.02×1023
x 3.01 ×1023 x= 5.6 L
则该反应产生气体的体积为5.6 L。
(3)A.正确,越稳定,键能越高,破坏它需要的能量越高,错误;B.都是固体,易混在一起,正确;C.前者氮化铝为还原产物,后者不是氧化还原反应,氮化铝不为还原产物,错误。
考点:本题以化工生产为基础,考查氧化还原反应等知识。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:填空题
硫、氮、稀土元素的单质和化合物应用广泛。
Ⅰ.(1)将硫铁矿和焦炭放在炼硫炉中,在有限空气中燃烧,发生下列反应:
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
生成3mol硫时,被氧化的物质物质的量为__ _________。
(2)过硫酸钾化学式为:K2S2O8,过硫酸结构式为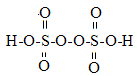
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是 。
| A.CuO | B.MnO2 | C.Fe2O3 | D.NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在 K2Cr2O7 +14HCl="2KCl" + 2CrCl3 + 3Cl2?+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用(未被氧化)的HCl的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知: NO3-+4H++3e-→NO+2H2O 。现有四种物质:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述还原过程发生的是 (填化学式),写出该反应化学方程式中氧化产物的化学计量数(写方框内)及其化学式□ 。1mol该物质与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向 。
(3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是 。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):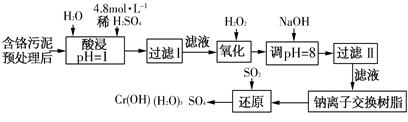
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把19.2 g 的Cu放入足量的稀硝酸中,微热至Cu完全反应。
已知:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O求:
(1)参加反应的硝酸的物质的量;
(2)被还原的硝酸的质量;
(3)生成的NO在标准状况下的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为 黄色 |
| ② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为 黄色 |
| 操作 | 现象 |
| | |
| 操作 | 现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com