
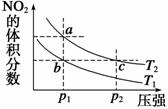
反应N2O4(g) 2NO2(g)ΔH =+57 kJ·mol-1,在温度为T1、T2时,
2NO2(g)ΔH =+57 kJ·mol-1,在温度为T1、T2时,
平衡体系中NO2的体积分数随压强(缩小体积)的
变化曲线如图所示。下列说法正确的是 ( )
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
B.100 mL 1 mol·L-1 K2SO4溶液 中含有的钾离子数为0.1NA
中含有的钾离子数为0.1NA
C.10克氖气所含原子数约为6.02×1023
D.常温常压下,NA个H2分子的体积小于22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为( )
A.-82kJ/mol B.-41kJ/mol C.-312kJ/mol D.+82kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于改变条件对活化分子影响的说法错误的是
A.温度不变时,增大反应物浓度可能增大活化分子的分子数
B.其他条件不变时,升高温度能使分子获得更高的能量,活化分子百分数提高
C.其他条件不变时,对于有气体参与和生成的反应而言,缩小体积增大体系
的压强能增大单位体积内的活化分子百分数
D.其他条件不变时,加人正催化剂能提高反应体系中含有的活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 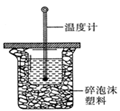 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越
越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
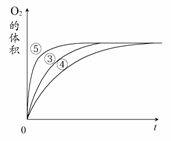
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)淀粉的化学式是 ;玻璃、陶瓷、水泥一定含 元素。造成赤潮的主要元素
是 ;油脂在体内水解后的产物是 和高级脂肪酸。
(2)常见的塑料有两类,一类是 塑料,如聚乙烯,一类是 塑料,如酚醛树脂等。
硫化后的橡胶适合制造汽车轮胎,加入 可增强轮胎的耐磨性。
(3)在“棉花、尼龙、黏胶纤维、蚕丝”这四中纤维中,属于天然纤维的是 ;属于
人造纤维的是 ;属于合成纤维的是 。
(4)药品标签上应贴有 “OTC”或“R”符号,①“OTC”它表示 ,②“R”表示 ,
氢氧化铝和碳酸氢钠都可用作抗胃酸药。写出:
③氢氧化铝与胃酸作用的离子方程式: ;
④碳酸氢钠与胃酸作用的化学方程式: 。
(5)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而
是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+
的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
①往KMnO4溶液中滴入维生素C溶液,KMnO4溶液褪色说明维生素C具有 性,
②人体长期缺乏维生素C会引起 病,
③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下
转化成亚铁盐。此反应的离子方程式为
(6)我国城市为了减少燃煤造成的大气污染,对民用燃料的煤作了多方面的改进。
①绿色能源是人类的理想能源不会造成环境污染,下列能源不属于绿色能源的是
A.氢能源 B.太阳能 C.风能 D.石油
②为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反
应:FeS2+14FeCl3+8H2O===2FeSO4+13FeCl2+16HCl 该反应中的氧化剂是 ;
为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新
利用生成FeCl3。请写出这一过程中有关的离子方程式:
、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com