
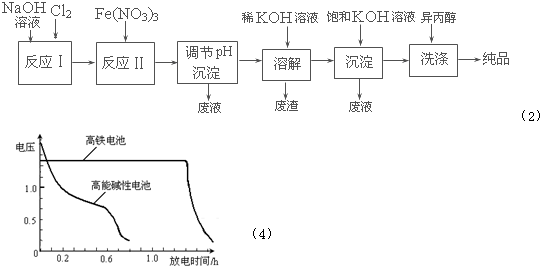
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
 △
△

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:


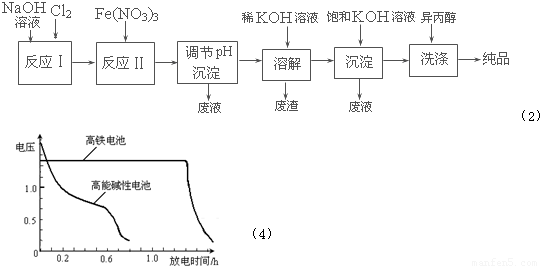
 右图为该电池和常用的高能碱性
右图为该电池和常用的高能碱性查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
 △
△查看答案和解析>>
科目:高中化学 来源:2011年广东省东莞高级中学高考化学二模试卷(解析版) 题型:解答题
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
 △
△查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com