
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
_________________________________________________________________
___________________________________ _____________________________________。
_____________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
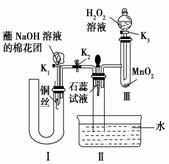
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至________后,迅速关闭K1,观察到U形管内的现象是____________
________________________________________________________________________。
②装置Ⅲ中发生反应的化学方程式为________________________________。
③蘸NaOH溶液的棉花团的作用是________________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并 未充满液体。设计简单方法检验长玻璃管中的气体是否含NO_____________
未充满液体。设计简单方法检验长玻璃管中的气体是否含NO_____________
________________________________________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的 氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。下列有关说法正确的是 ( )。
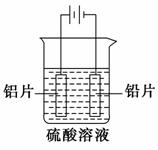
A.电解时电子从电源负极→导线→铝极,铅极→导线→电源正级
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+===2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的表格是元素周期表的一部分,其中的序号对应的是元素。

请回答下列问题:
(1) 按原子轨道的重叠方式看,元素①③形成的相对分子质量最小的分子中,含 键;元素⑤和⑧形成的化合键类型为 。
(2) 某元素的价电子排布式为 ,该元素与元素①形成的气态化合物分子的空间构型为 。
,该元素与元素①形成的气态化合物分子的空间构型为 。
(3) 表中某元素最外电子层上p电子数比s电子数少1,则该元素的元素符号为
(4) ②④⑤⑥四种元素的第一电离能由大到小的顺序是(填序号) 。
(5) 元素⑨的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法不正确的是( )

A.用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质
B.实验室可采用如图所示装置制取NH3
C.实验室可用CCl4检验NO2和溴蒸气
D.在常温下,稀硝酸的氧化性强于浓硫酸的
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸的产量常常被用做衡量一个国家工业发展水平的标志。下列有关硫酸的性质和使用的叙述中错误的是( )。
A.可以选用铁罐车储运浓硫酸
B.盛装浓硫酸的试剂瓶应印有如图所示的警示标记

C.稀释浓硫酸时应将浓硫酸慢慢注入水中
D.泄漏在水沟中的浓硫酸可以用生石灰进行掩埋
查看答案和解析>>
科目:高中化学 来源: 题型:
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。
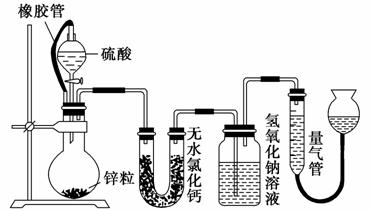
(1)该小组设计了如图所示的实验装置,检查该装置气密性的操作是_______________________________________________________________。
(2)若在烧瓶中放入1.30 g锌粒,与c mol·L-1 H2SO4反应,为保证实验结论可靠,量气管的适宜规格是(填字母)________。
A.100 mL B.200 mL C.400 mL D.500 mL
(3)若1.30 g锌粒完全溶解,氢氧化钠溶液洗气瓶增重0.64 g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为_______________
____________________________________________________________。
(4)若烧瓶中投入a g锌且完全反应,氢氧化钠溶液洗气瓶增重 b g,量气管中收集到V mL气体(标准状况),请用一个代数式表示出a、b、V之间的关系________。
b g,量气管中收集到V mL气体(标准状况),请用一个代数式表示出a、b、V之间的关系________。
(5)若撤走盛有无水氯化钙的U形管,则n(H2)/n(SO2)的数值将________(填“偏大”、“偏小”或“无影响”)。
(6)反应结束后,为了准确测量气体体积,读数时应注意的事项是________、________ 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置能达到实验目的是
 |
A、比较碳酸钠和碳酸氢钠热稳定性大小
B、用铜和稀硝酸制取并收集少量NO
C、验证氨气在水中溶解性
D、实验室用氯化铵制氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com