
����Ŀ����ͼ�������Լ�ƿ��ǩ�ϵ����ݣ�
��1������������ʵ���Ũ��Ϊ�� ��mol/L��
��2��ij��ѧС�������������ʵ��̽��ʱ����Ҫ240mL4.6mol/L��ϡ���ᣬ����Ҫȡ������Ũ���� mL��
��3��������Ũ�������ϡ�͵�ʵ������� ��
��4��������4.6mol/Lϡ����Ĺ����У����������������������Һ���ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ���ƫ�͡�����Ӱ�족����
��δ����ȴ���Ƚ���Һע������ƿ�У� ��
�ڶ���ʱ���Ӷ����� ��
������Ͳ��ȡŨ����ʱ���� ��
����Һʱ������������Һ��������ƿ���棺 ��
��5��ʵ������г����������Ӧ��δ�����
��������ƿ�м�������ˮ����̶���1��2cmʱ��Ӧ ��
�ڼ�����ˮʱ���������˿̶ȣ�Ӧ ��
���𰸡�18.4��62.5������ȡ��Ũ�������ձ��ڱڻ����ص���ʢ������ˮ���ձ��У����ò��������Ͻ��裻ƫ�ߣ�ƫ�ͣ�ƫ�ͣ�ƫ�ͣ����ý�ͷ�ιܵμӣ���������
����������1���ɱ�ǩ��֪����������������Ϊ98%���ܶ�Ϊ1.84g/mL���ʸ���������ʵ���Ũ��c= ![]() mol/L=18.4mol/L��
mol/L=18.4mol/L��
���Դ��ǣ�18.4��
��2����Ҫ��Ũ��������250ml240mL4.6mol/L��ϡ���ᣬ����ҪŨ�������ΪV������ϡ�Ͷ��ɣ�V��18.4mol/L=4.6mol/L��250mL�����V=62.5mL��
���Դ��ǣ�62.5��
��3��Ũ����ϡ�ͷ��ȣ�Ӧ����ȡ��Ũ�������ձ��ڱڻ����ص���ʢ������ˮ���ձ��У����ò��������Ͻ��裬
���Դ��ǣ�����ȡ��Ũ�������ձ��ڱڻ����ص���ʢ������ˮ���ձ��У����ò��������Ͻ��裻
��4����δ����ȴ���Ƚ���Һע������ƿ�У�����VƫС�����cƫ�ߣ�
���Դ��ǣ�ƫ�ߣ�
�ڶ���ʱ���Ӷ���������Vƫ����cƫ�ͣ�
���Դ��ǣ�ƫ�ͣ�
������Ͳ��ȡŨ����ʱ���ӣ�����nƫС����cƫ�ͣ�
���Դ��ǣ�ƫ�ͣ�
����Һʱ������������Һ��������ƿ���棬����nƫС����cƫ�ͣ�
���Դ��ǣ�ƫ�ͣ�
��5����������ƿ�м�������ˮ����̶���1��2cmʱ��Ӧ���ý�ͷ�ιܵμӣ�
���Դ��ǣ����ý�ͷ�ιܵμӣ�
�ڼ�����ˮʱ���������˿̶ȣ�����cƫС��Ӧ�������ƣ�
���Դ��ǣ��������ƣ�


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ������˵����ȷ���ǣ� ��
A.������������ʵ���Ũ�ȵ�NaX������HX��Ϻ����Һ�У�C��Na+����c��HX����c��X������c��H+����c��OH����
B.�����ʵ���Ũ�ȵ�������Һ����H2CO3��Na2CO3��NaHCO3�ܣ�NH4��2CO3��c��CO32�����Ĵ�С��ϵΪ���ڣ��ܣ��ۣ���
C.��0.1mol/L CH3COOH��Һ��ͨ������HCl������ĵ���ƽ�����淴Ӧ�����ƶ�������Һ�� ![]() ����
����
D.Na2CO3��Һ�У�2c��Na+��=c��CO32����+c��HCO3����+c��H2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���к��������֮һ���ϵ�Ԫ�أ���Ϊ����Ԫ�أ����������֮һ���µ�Ԫ�أ���Ϊ��Ԫ�ء����и���Ԫ���У�ȫ���Ǵ���Ԫ�ص��ǣ� ��
A.O S Mg C HB.Mo H O S Ca
C.Cu N P K FeD.P N K Ca B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L���ܱ������У�X��Y��Z(��Ϊ����)�������ʵ�����ʱ��ı仯������ͼ��ʾ��

��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
��2����Ӧ�ӿ�ʼ��2���ӣ���Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)=___________��
��3��2min��Ӧ��ƽ�������ڻ�������ƽ����Է�����������ʼʱ________(������С���ޱ仯����ͬ)����������ܶȱ���ʼʱ____________��
��4�����д�ʩ�ܼӿ췴Ӧ���ʵ���_______________��
A.��ѹʱ����He B.����ʱ����He C.����ʱ����X
D.��ʱ�����Z E.�����¶� F.ѡ���Ч�Ĵ���
��5������˵����ȷ����___________��
A.�����¶ȸı仯ѧ��Ӧ����
B.��֪����Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ�������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C.��ѧ��Ӧ������ʱ�䳤����
D.��ѧ��Ӧ�����Dz����ܸı��
E.����Y��Ũ�ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ�����������ʣ�û�������������
A.��ɫ������ҺB.��������ҺC.��������ҺD.��ɫʯ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ƽ���ͼ��ʾװ�D�����ּг�װ�ü���ȥ������ʵ��̽���� 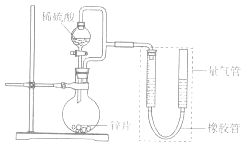
��1��������װ��̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�������9.0mL����Ϊ��ʱ�յ㣬���Ϊt1��t2 ��
��� | V��H2SO4��/mL | C��H2SO4��/molL��1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
�ٱȽ�ʵ��I�͢���Եó���ʵ������� ��
������пƬ���ɺ����ʵĴ�пƬ����������ʹ��������һ�£�����õķ�Ӧ���ʾ���������ʵ���Ӧ�����ݣ���пƬ���������ʿ�����������ţ���
A���������� B���� C��ͭ D��ʯī
��2��������װ����֤�����ڳ�ʪ�����лᷢ��������ʴ ��Բ����ƿ�е��Լ���ѡ��������ţ�
A��ϡHCl B��NaCl��Һ C���Ҵ� D��NaOH��Һ
����֤�������ڳ�ʪ�����лᷢ��������ʴ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ԣ� ![]() ��H2CO3��
��H2CO3�� ![]() ���ۺϿ��Ƿ�Ӧ���ת���ʺ�ԭ�ϳɱ������أ���
���ۺϿ��Ƿ�Ӧ���ת���ʺ�ԭ�ϳɱ������أ���  ת��Ϊ
ת��Ϊ  ����ѷ����ǣ� ��
����ѷ����ǣ� ��
A.��ϡH2SO4���Ⱥ���������NaOH��Һ
B.��ϡH2SO4���Ⱥ���������NaHCO3��Һ
C.��������NaOH��Һ���Ⱥ���ͨ������CO2
D.��������NaOH��Һ���Ⱥ��ټ�������H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��c(Cl-)��50 mL 1 mol��L-1 AlCl3��Һ��c(Cl-)��ȵ��� �� ��
A. 150 mL 1 mol��L-1��NaCl��Һ B. 75 mL 3 mol��L-1 MgCl2��Һ
C. 150 mL 2 mol��L-1��KCl��Һ D. 75 mL 1 mol��L-1��FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç����ṹ��ʽ��ͼ������˵��������ǣ� �� 
A.�����ʷ���ʽΪC7H10O5
B.�����������ụΪͬϵ��
C.�����������Ҵ�����������Ӧ
D.1mol��������Na��Ӧʱ���������Na 4mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com