
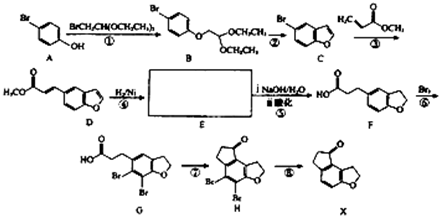
 ,同时生成HBr;
,同时生成HBr; ,故答案为:
,故答案为: ;
; ,同时生成HBr,反应方程式为:
,同时生成HBr,反应方程式为: ,
, ;
; 或
或 ,
, 或
或 ;
;

科目:高中化学 来源: 题型:
131 53 |
137 55 |
A、每个
| ||
| B、CsOH的碱性比NaOH弱 | ||
| C、KIO3是碘的最高价氧化物的水化物的盐 | ||
| D、I-比F-还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
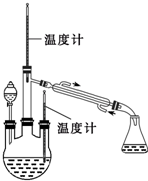 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的PH>7 |
| B、溶液中c(Na+)=2c(A2-)+c(HA)+c(H2A) |
| C、加水稀释,c(A2-)/c(HA-)减小 |
| D、加入NaOH固体,可使离子浓度满足:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
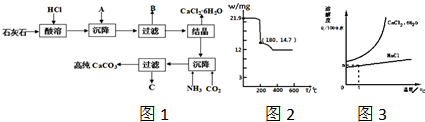
 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com