


科目:高中化学 来源: 题型:
| A、单质硅是良好的半导体材料 |
| B、硅和碳是都是第ⅣA族的元素 |
| C、二氧化硅用来制造通讯材料(光导纤维) |
| D、二氧化硅溶于水生成硅酸,它是挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| ① |
| 调pH约为5 |
| 适量高锰酸钾溶液② |
| 过滤 |
| Zn |
| ③ |
| 过滤 |
| Na2CO3 |
| ④ |
| 过滤 |
| 煅烧 |
| ⑤ |
| 金属离子 | Zn2+ | Fe2+ | Fe3+ | Ni2+ |
| 完全沉淀pH | 8.04 | 8.95 | 3.17 | 9.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
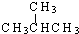 和
和 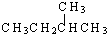 ②
②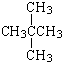 和
和 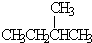
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钡溶液反应 H++OH-=H2O |
| B、硫酸铝溶液中滴入氨水 Al3++OH-=Al(OH)3↓ |
| C、将足量CO2通入偏铝酸钠溶液中 Al3++CO2+H2O=Al(OH)3↓+CO32- |
| D、硝酸铝溶液中滴加少量氢氧化钠溶液 Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com