
【题目】化学是以实验为基础的自然科学,下列实验操作方法正确的是()
A. 酒精灯在桌子上歪倒着火,立即用水浇灭
B. 给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
C. 使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水润湿后,再测量
D. 将润湿的红色石蕊试纸置于集气瓶内部,试纸变蓝说明氨气已收集满
科目:高中化学 来源: 题型:
【题目】化学中有许多的“守恒或相等“下列说法不正确的是
A. 化学反应中,反应物总能量与生成物总能量
B. 溶液中,阳离子电荷总数与阴离中电荷总数
C. 溶液中,稀释前后溶质质量与稀释后溶质质量
D. 化学反应中,参加反应物总质量与生成物总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中,正确的是( )
A.原电池负极发生的电极反应是还原反应
B.原电池是将化学能转化为电能的装置
C.原电池在工作时其正极不断产生电子经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是( )
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
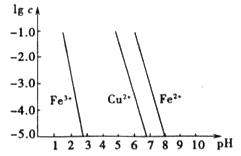
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M通过下列关系可以得到阿司匹林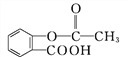 和能放出扑热息痛(
和能放出扑热息痛(![]() )的高分子药物(
)的高分子药物(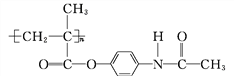 )。
)。

已知:①![]()
![]()
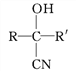
![]()
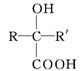 (R、R'表示氢原子或烃基);
(R、R'表示氢原子或烃基);
②C中含有一个甲基,且与H互为同系物。
请回答问题:
(1)I含有的官能团的名称为________。
(2)F→G的反应类型为________,I→J的反应类型为_______。
(3)M的结构简式为________。
(4)满足下列条件的D的同分异构体有____种。
①能与FeCl3溶液发生显色反应;②能发生银镜反应
(5)①E→F的化学方程式为_______________________。
②1 mol阿司匹林与足量NaOH溶液反应最多消耗NaOH的物质的量为________mol。阿司匹林与足量的NaOH溶液共热的化学方程式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于催化剂的说法正确的是
A. 使用催化剂可以增大正反应速率,减小逆反应速率
B. 使用催化剂可以使化学平衡正向移动
C. 使用催化剂可以降低反应的活化能
D. 使用催化剂可以改变反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
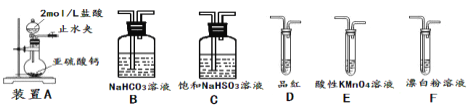
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A![]() ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
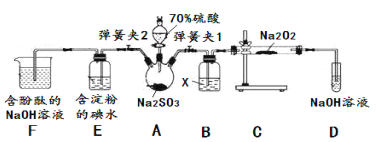
操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com