
����Ŀ����֪NO2��N2O4�����ת������Ӧ2NO2��g��![]() N2O4��g����H����57.2kJ/mol��
N2O4��g����H����57.2kJ/mol��
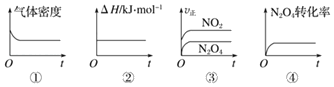
��1��һ���¶��£��ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����___������ţ���ͬ����
��2������Ӧ2NO2��g��N2O4��g�������Ϊ1L�ĺ����ܱ������н��У������¶Ȳ��䣬�ﵽƽ�����Ӧ�������ٳ�������N2O4��ƽ����___�ƶ���������ҡ�������������ƽ����ԭƽ����ȣ����������ɫ___����������dz�����䡱����N2O4 ���������___�����������С�����䡱����
��3��һ���¶��£����ݻ�Ϊ20L���ܱ������г���1molNO2���壬������Ӧ2NO2��g��N2O4��g������Ӧ�в��������������ʾ��
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 |
������Է������� | 46 | 57 | 64 | 69 | 69 | 69 |
�ٴ������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K��___��
����50minĩ���������м���![]() molNO2����Ҫ����ƽ�ⲻ�����ƶ���Ӧ����N2O4Ϊ___mol��
molNO2����Ҫ����ƽ�ⲻ�����ƶ���Ӧ����N2O4Ϊ___mol��
���𰸡��٢� �� ���� ���� 60 ![]()
��������
��1��δ�ﵽƽ��״̬ʱ��ϵ��ijЩֵ�Dz��ϱ仯�ģ�����Щֵ����ʱ��˵����Ӧ�ﵽƽ��״̬��
��2��������������Ϊ����ɫ������������Ũ����������ɫ���
��3����ƽ�ⳣ��K=![]() ��
��
��Ũ���̵���ƽ�ⳣ��ʱƽ�ⲻ�����ƶ���
��1��a.�÷�Ӧ������仯�ķ�Ӧ���ܱ������������������䣬�����ܶȲ��䣬˵���ﵽ��ƽ��״̬���ʢ���ȷ��
b.��Ӧ�ȡ�H�뻯ѧ��Ӧ����ʽ�йأ��Dz��仯�ģ����ԡ�Hʼ�ղ��䣬�����ж��Ƿ�ﵽƽ��״̬���ʢڴ���
c.��������Ӧ���ʴ�С��ϵ�����ж�ͬһ���ʵ����淴Ӧ�����Ƿ���ȣ��ʢ۴���
d.������������ת���ʲ��䣬˵��������������Ũ�Ȳ��䣬˵����Ӧ�ﵽ��ƽ��״̬���ʢ���ȷ��
�ʴ�Ϊ���٢ܣ�
��2�����淴ӦΪ2NO2��g��N2O4��g�����ﵽƽ�����Ӧ�������ٳ�������N2O4��������Ũ������ƽ�������ƶ���c��NO2�������������ɫ��������ܱ��������������ʱ�ɿ�������ѹǿ��ѹǿ����ʱƽ�������ƶ�������N2O4������������ʴ�Ϊ���������
��3���ٷ�Ӧ2NO2��g��N2O4��g��������ʽΪ��
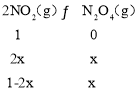
������������Ϊ46g��ƽ��ʱ������������Է�������Ϊ69����69��1��2x+x����46��x��![]() mol��c��NO2����c��N2O4����
mol��c��NO2����c��N2O4����![]() ��
��![]() mol/L��
mol/L��
�� �÷�Ӧ�Ļ�ѧƽ�ⳣ��K��![]() ��
��![]() ��60���ʴ�Ϊ��60��
��60���ʴ�Ϊ��60��
����ƽ��ʱN2O4��Ũ��Ϊc��N2O4�����������м���![]() molNO2����ʱc��NO2����
molNO2����ʱc��NO2����![]() ��0.05mol/L����ѧƽ�ⳣ��K��
��0.05mol/L����ѧƽ�ⳣ��K��![]() ��
��![]() ��60����c��N2O4����0.15mol/L��n��N2O4����cV��20L��0.15mol/L��3mol������Ӧ����N2O4�����ʵ���Ϊ3mol��
��60����c��N2O4����0.15mol/L��n��N2O4����cV��20L��0.15mol/L��3mol������Ӧ����N2O4�����ʵ���Ϊ3mol��![]() mol��
mol��![]() mol���ʴ�Ϊ��
mol���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������X����ij�ܱ������У�������Ӧ��2X(g)![]() 3Y(g)+Z(g)�����������X�����ʵ����������¶ȹ�ϵ��ͼ��ʾ�������ƶ���ȷ����()��
3Y(g)+Z(g)�����������X�����ʵ����������¶ȹ�ϵ��ͼ��ʾ�������ƶ���ȷ����()��
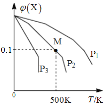
A. �����¶ȣ��÷�Ӧƽ�ⳣ��K��С
B. ѹǿ��С��P3��P2��P1
C. ƽ�������Ч����ʹƽ��Ħ����������
D. �ڸ�������M��Xƽ��ת����Ϊ9/11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǦ�����صĹ���ԭ����ͼ��ʾ�����ܷ�ӦʽΪ![]() �������жϲ���ȷ����
�������жϲ���ȷ����

A.�պ�Kʱ��d�缫�ķ�ӦʽΪ![]()
B.����·��ת��![]() ����ʱ���������ĵ�
����ʱ���������ĵ�![]() Ϊ
Ϊ![]()
C.�պ�Kʱ������![]() ��c�缫Ǩ��
��c�缫Ǩ��
D.�պ�Kһ��ʱ���ɵ�����Ϊԭ��أ�d�缫Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɳ����ԭ�����͵���
A. Fe��SCN��3��Һ�м������KSCN����ɫ����
B. �غ�ɫBr2������ѹ����ɫ����
C. SO2��������SO3�ķ�Ӧ��������Ҫʹ�ô���
D. H2��I2��HIƽ��������ѹ����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
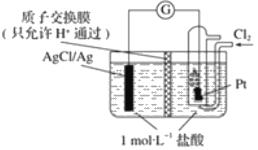
����Ŀ��ijԭ���װ����ͼ��ʾ������ܷ�ӦΪ 2Ag+Cl2�T2AgCl��
��1��д���õ�ع���ʱ��������Ӧ��������___��������___��
��2������·��ת��amole��ʱ������Ĥ�����Һ��Լ����___mol���ӣ�����Ĥ�Ҳ���Һc��HCl��___�������������������1molL-1��������Һ����仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FFC��ⷨ���ɽ���������ֱ�ӵ���Ʊ��������ʣ�����ϡ�н��������о�Ժ���ô˷��ɹ�����Ʊ����(Ta)����ԭ����ͼ��ʾ������˵����ȷ����
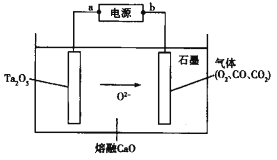
A. ��װ�ý���ѧ��ת��Ϊ����
B. a��Ϊ��Դ������
C. Ta2O5�������ĵ缫��ӦΪTa2O5+10e��=2Ta+5O2��
D. ʯī�缫������22.4 L O2�����·��ת�Ƶĵ�����Ϊ4��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������أ�����˵����ȷ���ǣ� ��
A.����������Ƕп�����������Է����屻��ʴ
B.����β����NO��CO���Ի�����Ӧ����N2��CO2����Сѹǿ����Ӧ���ʼ���
C.����ұ�������ǽ������ӵõ��ӱ�ɽ������ʵ���������
D.PM2.5����![]() ��ֱ��ԼΪ2.5��106m)��ɢ�ڿ������γ����ܽ�
��ֱ��ԼΪ2.5��106m)��ɢ�ڿ������γ����ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�����������
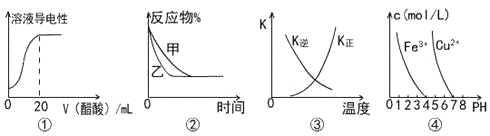
A.ͼ�ٱ�ʾ��20 mL 0.1 mol/L��ˮ����μ���0.1 mol/L���ᣬ��Һ�����������������ı仯
B.ͼ�ڱ�ʾѹǿ�Կ��淴ӦA(g)+2B(g)![]() 3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
C.ͼ�������߱�ʾ��Ӧ3A(g) + B(g)![]() 2C��g����H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2C��g����H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
D.��ͼ�ܣ���Ҫ��ȥCuSO4��Һ�е�Fe3+���ɼ���NaOH��Һ��pH��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�������������Һ��A.0.1mol/LNH4Cl B.0.1mol/L CH3COONH4 C.0.1mol/LNH4HSO4 D.0.1mol/LNH4HCO3 E.0.1mol/LNaHCO3
�����Ҫ����д���пհף�
��1����ҺA��___��(������������������������)����ԭ���ǣ�___(�����ӷ���ʽ��ʾ)��
��2����ҺE��___��(������������������������)����ԭ���ǣ�___(�����ӷ���ʽ��ʾ)��
��3���Ƚ���ҺA��C��c(NH4+)�Ĵ�С��ϵ��A___C(����>������<������=��)��
��4�������£������ҺB��pH=![]() ����CH3COO-��ˮ��̶�___NH4+��ˮ��̶�(����>������<������=��)��CH3COO-��NH4+Ũ�ȵĴ�С��ϵ�ǣ�c(CH3COO-)___c(NH4+)(����>������<������=��)��
����CH3COO-��ˮ��̶�___NH4+��ˮ��̶�(����>������<������=��)��CH3COO-��NH4+Ũ�ȵĴ�С��ϵ�ǣ�c(CH3COO-)___c(NH4+)(����>������<������=��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com