
【题目】下列图示与对应叙述相符的是
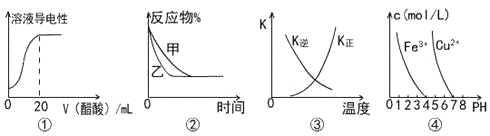
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
【答案】B
【解析】
A. 一水合氨是弱电解质,电离产生的离子的浓度较小,所以导电能力较弱,当向其中加入等浓度的醋酸时发生反应:CH3COOH+NH3·H2O=CH3COONH4+H2O。CH3COONH4是容易溶解的强电解质,在水中完全电离,自由移动的离子浓度增大,导电能力增强,当加入的醋酸溶液的体积与氨水相同时二者恰好完全反应。在完全反应之前,溶液的导电性显著增强,之后再加入醋酸,就不能再发生反应,醋酸溶液对原来的溶液还起到了稀释作用,所以导电能力还有所减小,不会是没有多大的变化,A错误。
B. 对于有气体参加的化学反应来说,增大压强,化学反应速率加快,达到平衡所需要的时间缩短。即压强大,先达到平衡状态。由于反应前后体积不变,增大压强平衡不移动,B正确。
C.反应3A(g) + B(g)![]() 2C(g)△H<0,正反应为放热反应,逆反应为吸热反应。升高温度,化学平衡逆向移动,K正减小,K逆增大,但在任何时刻K正·K逆=1互为倒数,C错误。D. 除去杂质的原则是不增、不减。即:不增加新的杂质离子,不减少被提纯的物质本身。若要加入NaOH溶液除去CuSO4溶液中的Fe3+至pH在4左右,就会引入新的杂质离子Na+。不能选用,应该向其中加入CuO或Cu(OH)2等来调节溶液的pH,D错误。
2C(g)△H<0,正反应为放热反应,逆反应为吸热反应。升高温度,化学平衡逆向移动,K正减小,K逆增大,但在任何时刻K正·K逆=1互为倒数,C错误。D. 除去杂质的原则是不增、不减。即:不增加新的杂质离子,不减少被提纯的物质本身。若要加入NaOH溶液除去CuSO4溶液中的Fe3+至pH在4左右,就会引入新的杂质离子Na+。不能选用,应该向其中加入CuO或Cu(OH)2等来调节溶液的pH,D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是

A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用制度,一律不得免费提供塑料购物袋。在全国范围内禁止生产、销售、使用厚度小于0.025毫米的塑料购物袋(简称超薄塑料购物袋)。下列说法不正确的是( )
A.在所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用制度,主要目的是控制塑料制品的使用,减少“白色污染”
B. 的单体是苯乙烯
的单体是苯乙烯
C.聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品
D.用于食品包装的塑料制品,属于热塑性塑料,可回收再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列问题涉及前 20 号元素,请按要求用相应的化学用语作答:
(1)族序数等于周期数 2 倍的元素_____
(2)最外层电子数是内层电子数的一半且单质可作为电极材料的元素, 其在周期表中的位置是_____
(3)原子半径最大的短周期元素和地壳中含量最多的元素形成原子个数比为 1:1 的化合物,其阴离子符号为________________________________
(4)最高正价与最低负价代数和为零的短周期元素,其最高价氧化物与短周期元素中最稳定的气态氢化物的水溶液间发生反应的化学方程式___________________________
(5)第三周期元素中,简单离子半径最小的元素,其离子结构示意图为_____
(6)简单离子 Xn+与 Yn-具有相同的电子层结构,X n+的焰色为淡紫色,则 Y 的最高价氧化物对应水化物的名称为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究![]() 反应的速率影响因素,设计了以下实验。下列说法正确的是
反应的速率影响因素,设计了以下实验。下列说法正确的是
锥形瓶标号 |
| 蒸馏水 |
| 反应温度 | 浑浊出现时间 | 备注 |
1 |
| 0 mL | 10 mL |
| 10s | |
2 | 10mL | 5mL | 5 mL |
| 16 s | |
3 | 10mL | 0mL | 10 mL |
| 5 s | 第10s开始浑浊不再增多 |
4 | 10mL | 6mL | 4mL |
| 8s |
A.该反应也可通过测![]() 的体积变化来表示化学反应速率的快慢
的体积变化来表示化学反应速率的快慢
B.3号瓶用![]() 来表示速率为
来表示速率为![]()
C.由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D.由1号瓶和4号瓶实验结果可得温度越高反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因可能是( )
A.所用NaOH已潮解
B.定容时,俯视刻度线
C.用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘
D.托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]() ,所得实验数据如下表,下列说法正确的是
,所得实验数据如下表,下列说法正确的是 ![]()
![]()
实验编号 | 温度 | 起始时物质的量 | 平衡时物质的量 | ||
|
|
|
| ||
① | 800 |
|
|
|
|
② | 800 |
|
| a | a |
③ | 900 |
|
|
|
|
A.正反应为放热反应
B.实验①中,反应![]() 达平衡,用X表示的平均反应速率
达平衡,用X表示的平均反应速率![]()
C.实验②中,该反应的平衡常数![]()
D.实验②中,达到平衡时,a大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:A(s)![]() B(s)+C(g)+4D(g),若测得生成的气体质量是同温同压下相同体积氢气的10倍,且当所生成的气体体积在标准状况下为22.4L时,所得B的质量为30.4g,则A的摩尔质量为( )
B(s)+C(g)+4D(g),若测得生成的气体质量是同温同压下相同体积氢气的10倍,且当所生成的气体体积在标准状况下为22.4L时,所得B的质量为30.4g,则A的摩尔质量为( )
A.130.4gmol-1B.50.4gmol-1
C.182.4gmol-1D.252gmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com