
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是

A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(1)锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂离子电池容量的10倍,其工作原理示意图如图所示。

放电时,b电极为电源的极_______,电极反应式为_______。
(2)汽车尾气中![]() 、
、![]() 在一定条件下可发生反应
在一定条件下可发生反应![]() ,定温度下,向容积固定的
,定温度下,向容积固定的![]() 密闭容器中充入一定量的
密闭容器中充入一定量的![]() 和
和![]() ,
,![]() 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。

①![]() 内该反应的平均速率
内该反应的平均速率![]() _______,从
_______,从![]() 起其他条件不变,压缩容器的容积变为
起其他条件不变,压缩容器的容积变为![]() ,则
,则![]() 的变化曲线可能为图中的_______(填字母)。
的变化曲线可能为图中的_______(填字母)。
②恒温恒容条件下,不能说明该反应已经达到平衡状态的是_______(填序号)。
a.容器内混合气体颜色不再变化 b.容器内的压强保持不变 c.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时,生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.②③④B.①③⑤C.①④⑥D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
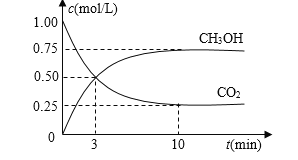
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____mol/(L·min)。
②该反应的平衡常数表达式为K=_________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵有人提出,可以设计反应2CO(g)=2C(s)+O2(g) 通过其自发进行来消除CO的污染。该方案_______(填“是”、“否”)可行,理由是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
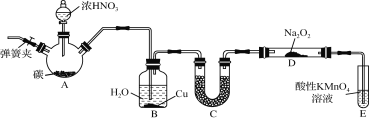
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 锶(Sr)原子序数为 38,在周期表中的位置为_____关于锶及其化合物的说法中不正确的是_________
a. 锶能与冷水剧烈反应
b. 锶的失电子能力比钙强
c. Sr(OH)2 的碱性比 Ca(OH)2 弱
d. 氧化锶是碱性氧化物
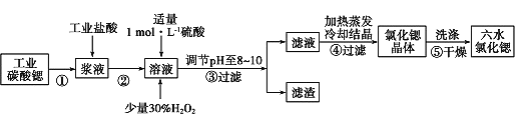
II.高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量 Ba、Fe 的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
请回答:
(1)已知常温下,NaCl 溶液、BaCl2 溶液呈中性,而 MgCl2 、CuCl2 溶液呈酸性。常温下,SrCl2 溶液 pH_____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是_________(填化学式),调节溶液 pH 至 8~10,宜选用的试剂为_____。
a.稀硫酸 b.氢氧化锶粉末 c.氢氧化钠 d.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用_____。
a.水 b.稀硫酸 c.氢氧化钠溶液 d.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是_____(填字母)。
a.50~60℃ b.70~80℃ c.80~100℃ d.100℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺![]() 的性质与氨相似,
的性质与氨相似,![]() 也是一元弱碱,
也是一元弱碱,![]() 时电离常数
时电离常数![]() 。现用
。现用![]() 的稀硫酸滴定
的稀硫酸滴定![]() 的甲胺溶液,溶液中
的甲胺溶液,溶液中![]() 的负对数pOH与所加稀硫酸的体积
的负对数pOH与所加稀硫酸的体积![]() 的关系如图所示,下列说法正确的是( )
的关系如图所示,下列说法正确的是( )
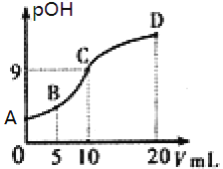
A.B点溶液中存在![]()
B.甲胺在水中的电离方程式为:![]()
C.A、B、C三点溶液中,由水电离出来的![]() :
:![]()
D.C点所在溶液中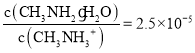
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
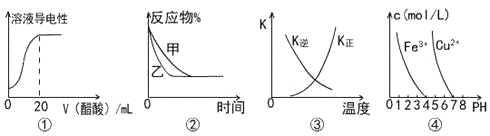
A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图③中曲线表示反应3A(g) + B(g)![]() 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
2C(g)△H<0,正、逆反应的平衡常数K随温度的变化
D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com