
【题目】I. 锶(Sr)原子序数为 38,在周期表中的位置为_____关于锶及其化合物的说法中不正确的是_________
a. 锶能与冷水剧烈反应
b. 锶的失电子能力比钙强
c. Sr(OH)2 的碱性比 Ca(OH)2 弱
d. 氧化锶是碱性氧化物
II.高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量 Ba、Fe 的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
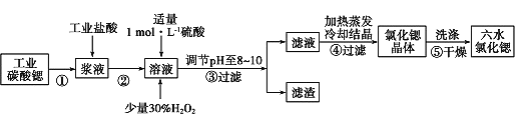
请回答:
(1)已知常温下,NaCl 溶液、BaCl2 溶液呈中性,而 MgCl2 、CuCl2 溶液呈酸性。常温下,SrCl2 溶液 pH_____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是_________(填化学式),调节溶液 pH 至 8~10,宜选用的试剂为_____。
a.稀硫酸 b.氢氧化锶粉末 c.氢氧化钠 d.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用_____。
a.水 b.稀硫酸 c.氢氧化钠溶液 d.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是_____(填字母)。
a.50~60℃ b.70~80℃ c.80~100℃ d.100℃以上
【答案】第五周期ⅡA 族 c 等于 BaSO4、Fe(OH)3 b d d a
【解析】
I.锶(Sr)原子序数为 38,原子结构示意图为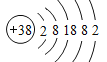 ;锶、钙同主族,根据元素性质递变规律判断;
;锶、钙同主族,根据元素性质递变规律判断;
II.以SrCO3为原料制备六水氯化锶(SrCl2·6H2O),由流程可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2·6H2O。
(1)锶(Sr)原子序数为 38,原子结构示意图为 ,有5个电子层,最外层2个电子,在周期表中的位置为第五周期ⅡA 族;
,有5个电子层,最外层2个电子,在周期表中的位置为第五周期ⅡA 族;
a. 锶的活金属性大于钙,所以锶能与冷水剧烈反应,故a正确;
b.锶、钙同主族,锶的半径大于钙,所以锶的失电子能力比钙强,故b正确;
c.锶、钙同主族,锶的半径大于钙,Sr(OH)2 的碱性比 Ca(OH)2 强,故c错误;
d. 氧化锶和盐酸反应生成氯化锶和水,氧化锶是碱性氧化物,故d正确;选c。
II.(1)SrCl2是强酸强碱盐,SrCl2溶液呈中性,pH等于7;
(2)SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为BaSO4、Fe(OH)3;调节pH除去Fe3+等,要不能引入杂质,最好选用氢氧化锶粉末或氧化锶粉末,故选bd;
(3)SrCl2·6H2O易溶于水,为减少晶体溶解,提高产量,洗涤氯化锶晶体最好选用氯化锶饱和溶液,选d;
(4)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃,故选a。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为Na2SO4+2C![]() Na2S+2CO2↑。其主要流程如下:
Na2S+2CO2↑。其主要流程如下:

(1) Na2S溶液显碱性,写出相关反应的方程式(主要)______,上述流程中采用稀碱液比用热水更好,理由是___________。
(2)常温下,等体积、等物质的量浓度的NaHS溶液与Na2S溶液混合,混合溶液中c(S2-)_____c(HS-) (填“大于”、“小于”或“等于”)。若混合溶液的pH=10,则c(HS-)+3c(H2S)-c(S2-)= ___________________
(3)已知:I2+2S2O32-=2I-+S4O62-。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1I2溶液滴定至终点,用去5.00mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是

A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。
请回答下列问题:
(1)元素X的名称是_______。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二乙酸—1,4—环己二醇酯可通过下列路线合成:
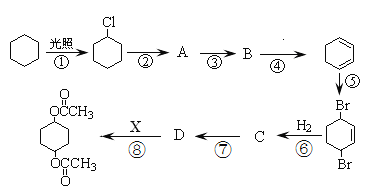
(1)化合物的结构简式:B___;D___。
(2)上述合成过程中没有涉及的反应类型是___。
A.加成 B.消去 C.取代 D.氧化 E.聚合 F.酯化
(3)反应④和反应⑧的反应条件:④___;⑧___。
(4)写出②的反应方程式___;写出⑤的反应方程式___。
(5)请设计合理的方案以CH2=CH—CH=CH2(1,3—丁二烯)和醋酸为原料合成 (用合成路线流程图表示,并注明反应条件)___。
(用合成路线流程图表示,并注明反应条件)___。
提示:①合成过程中无机试剂任选;②合成路线流程图示例如:
CH3CH2OH![]() H2C=CH2
H2C=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.X的化学式为C8H10
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用制度,一律不得免费提供塑料购物袋。在全国范围内禁止生产、销售、使用厚度小于0.025毫米的塑料购物袋(简称超薄塑料购物袋)。下列说法不正确的是( )
A.在所有超市、商场、集贸市场等商品零售场所实行塑料购物袋有偿使用制度,主要目的是控制塑料制品的使用,减少“白色污染”
B. 的单体是苯乙烯
的单体是苯乙烯
C.聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品
D.用于食品包装的塑料制品,属于热塑性塑料,可回收再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因可能是( )
A.所用NaOH已潮解
B.定容时,俯视刻度线
C.用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘
D.托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com