
依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3的酸性比H2CO3的强 B.氢氧化钡的碱性比氢氧化钙的碱性强
C.硒化氢比硫化氢稳定 D.若Xm+ 和Yn- 核外电子层结构相同,则在周期表中X、Y的族序数之差一定为:(m+n)-8
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
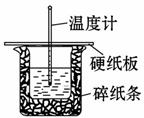
某学生实验小组用50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定。
(1)图中装置缺少一种仪器,该仪器名称为______。
(2)下列说法正确的是______。
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
两种微粒的质子数和电子数分别都相等,它们可能是( )
A、一种阳离子和一种阴离子 B、一种单质分子和一种化合物分子
C、一种分子和一种离子 D、一种原子和一种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是
A.该反应是放热反应 B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
A.通CO的一极是电池的正极,
B.该电池工作过程中需不断补充CO和O2,CO2可循环利用
C.负极反应式:O2+2CO2+4e-==2CO32-
D.该电池工作过程中有蓝色火焰产生
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强。

(1) 写出X在周期表中的位置 。
(2)W的简单离子的还原性比Y简单离子的还原性 (填强或弱);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与W形成的化合物和Z单质水溶液反应,生成二种强酸,该反应的化学方程式是 。
(4)已知25℃时,2.3gC2H5OH(l)在足量的W单质充分反应后恢复原状,放出68.34kJ热量, 则该反应的热化学方程式:
 (5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
(5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列实验装置进行的相应实验,不能达到实验目的的是

A.用图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制取乙烯并验证其易被氧化
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com