
����Ŀ��ijʵ��С������ϡ������п����ȡ������ʵ��̽��Ӱ�컯ѧ��Ӧ���ʵ����أ���Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ����ش��������⣺
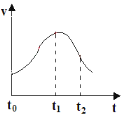
��1��t0~t1�䷴Ӧ���������ԭ����___��
��2������t2ʱ������Һ�м�������CuSO4���壬��Ӧ�������Լӿ죬�Դ˴��չ���о���
��������Ϊ�Ǽ����SO42-���˷�Ӧ�����Ĺ۵�___��������ȷ����������ȷ������������ʵ�����֤����___��
����ͬѧ���ֵ�����϶�CuSO4����ʱ����Ӧ���ʷ����½������ܵ�ԭ����___��
��3����Ҫ�ӿ�t0ʱ��������������ʣ��ӷ�Ӧ��Ƕȿ����ɲ�ȡ�Ĵ�ʩ��___(���ٴ�����)��
���𰸡��÷�Ӧ���ȣ�ʹ�¶����ߣ��Ӷ��ӿ��˷�Ӧ���� ����ȷ ������Һ�м�������Na2SO4���壬�۲췴Ӧ���ʱ仯 п�û����϶�ͭ��������пƬ���棬��ֹ�˷�Ӧ�ķ��� �ʵ��Ӵ�ϡ�����Ũ�ȡ���пƬ����
��������
������������Է�Ӧ���ʵ�Ӱ���Լ���Ӧʵ�ʷ������
��1��Zn��ϡ���ᷴӦ���ȣ����ŷ�Ӧ�IJ��Ͻ��У���Ӧ�ų��������ȣ�ʹ��ϵ�¶����ߣ��¶����ӿ췴Ӧ���ʣ���t0-t1�η�Ӧ��������
��2����t2ʱ�̼�������ͭ����Ӧ���ʼӿ죬��ΪZn������Cu2+�����û���Ӧ����Cu��Cu-Zn-ϡ�������ԭ���װ�ã��ӿ췴Ӧ���ʣ��ʸ�ͬѧ�Ĺ۵��Dz���ȷ�ģ�������������Ӧ�Ľ��У�����ͨ������Һ�м��������ƹ��������֤�������������ƹ����Ӧ���ʼӿ죬��˵�������������ã���֮��û�������ã�
�ڵ������������ͭʱ��Cu2+��Zn��Ӧ���ɴ���Cu������Zn���棬��ֹZn�Ľ�һ����Ӧ��
��3��Ϊ���ӳ�ʼ״̬�µķ�Ӧ���ʣ������ʵ���������Ũ�ȡ���п�������Zn��ϡ����ĽӴ�����ȷ�����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ͬpH������һԪ����HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpH���ˮ����仯��������ͼ��ʾ������˵����ȷ����

A. HB������ǿ��HA
B. a����Һ�ĵ����Դ���b����Һ
C. ͬŨ�ȵ�NaA��NaB��Һ�У�c(A-)=c(B-)
D. ��ˮϡ�͵�pH��ͬʱ����HA��HB�õ���ˮV(A)С��V(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�Ļ�ѧʽΪNH5����������ԭ�ӵ�����㶼������Ӧϡ�������������Ӳ�ṹ���������й�˵������ȷ���ǣ� ��
A. 1 mol NH5�к���5 NA��N��H����NA��ʾ�����ӵ�������
B. NH5�м��й��ۼ��������Ӽ�
C. NH5�ĵ���ʽΪ![]()
D. ����ˮ��Ӧ�����ӷ���ʽΪNH4++H��+H2O=NH3H2O+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2������Al��CO2��ع���ԭ����ͼ��ʾ���õ�ص�����������Ч����CO2����ط�Ӧ����Al2(C2O4)3����Ҫ�Ļ���ԭ�ϡ��õ�ض��̼�缫�ķ�ӦʽΪ�� 6O2 + 6e = 6O2 6CO2+6O2 = 3C2O42+6O2����װ�ù���ʱ����˵������ȷ����
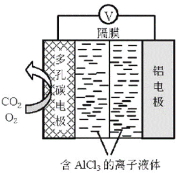
A.���̼�缫������������ɢ���缫����
B.���缫Ϊ�ϵĵ��Ʊȶ��̼�缫�ϵĸ�
C.��Ӧ������O2�������Ǵ���
D.�õ�ص��ܷ�ӦʽΪ��2Al+6CO2=Al(C2O4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɳ���������������Ƽ������������Խ᳦��ҩ�����ˮ����Ϊ��ʼ��ĺϳ�·�����£�
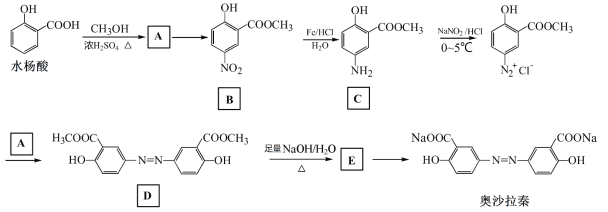
�ش��������⣺
(1) A�Ľṹ��ʽΪ______����A�Ʊ�B�ķ�Ӧ�Լ�������Ϊ______��
(2) ��B�Ʊ�C�ķ�Ӧ����Ϊ______��
(3)��D����E�ķ�Ӧ����ʽΪ______��
(4) ��ҵ�ϳ��������۵�CO2��E��Ӧ�Ʊ���ɳ���أ�ͨ���CO2��E�����ʵ���֮������ӦΪ______��
(5) ��ɳ���صĻ�ѧʽΪ______����˴Ź�������Ϊ______��壬�������Ϊ______��
(6) F��ˮ�����ͬ���칹�壬���Է���������Ӧ��F�����ˮ������ữ���Եõ��Ա����ӡ�F�Ľṹ��ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ͼ�﮵�ز��Ϻ��������(LiCoO2)�������ʯī�����۵ȡ����շϾ�﮵�����ܵĹ����������£�
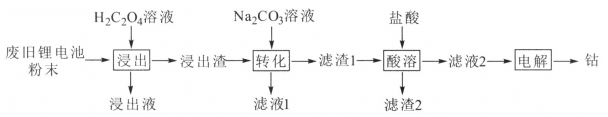
��֪��Ksp(CoC2O4)=6.0��10-8��Ksp(CoCO3)=1.5��10-13��
�ش��������⣺
(1) LiCoO2�У�CoԪ�صĻ��ϼ�Ϊ______________��
(2)������Һ������Ҫ�ɷ���LiHC2O4��Al(HC2O4)3����������������Ҫ�ɷ���CoC2O4����������������CoC2O4�Ļ�ѧ����ʽΪ__________����H2C2O4��������CoC2O4�IJ��ʷ����ή�ͣ�ԭ����____��
(3)��ת�����м���Na2CO3��Һ������Ӧ�����ӷ���ʽΪ______________���÷�Ӧ���еij̶Ƚϴ���ͨ��������ƽ�ⳣ��K������ԭ��______________��
(4)�������ʱװ����ͼ��ʾ�������ĵ缫��ӦʽΪ_______������a���еĵ��Һ�ɷ��ع������ʹ�á�
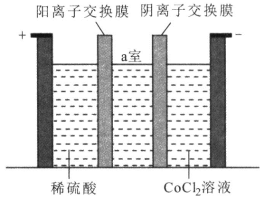
(5)ij�Ͼ�﮵�ط�ĩ��LiCoO2����������Ϊ49%����50�ָ÷��Ͻ��л������ã����õ���5.9�֣����ܵĻ�����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ӦC(s)��H2O(g)![]() CO(g)��H2(g)��ƽ����뵥��̼ƽ��ض�������Ӧ�����ƶ�
CO(g)��H2(g)��ƽ����뵥��̼ƽ��ض�������Ӧ�����ƶ�
B.A2(g)��3B2(g)![]() 2AB3(g)��ƽ�������������ѹǿ���䣬����ͨ��0.2mol A2��0.6mol B2��ƽ��������Ӧ�����ƶ�����A2��ת����һ�����
2AB3(g)��ƽ�������������ѹǿ���䣬����ͨ��0.2mol A2��0.6mol B2��ƽ��������Ӧ�����ƶ�����A2��ת����һ�����
C.2RO2(g)��O2(g)![]() 2RO3(g) ��H����197kJ��mol��1�������¶ȣ�����Ӧ���ʼ�С
2RO3(g) ��H����197kJ��mol��1�������¶ȣ�����Ӧ���ʼ�С
D.��һ���¶��£�һ���ݻ����ܱ������з�����Ӧ��C(s)��H2O(g)![]() H2(g)��CO(g)���������������ƽ�������������ٷ����仯ʱ����Ӧ�ﵽƽ��
H2(g)��CO(g)���������������ƽ�������������ٷ����仯ʱ����Ӧ�ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
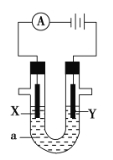
��1����X��Y���Ƕ��Ե缫��a��AgNO3��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸��ʯ����Һ����
��������Y�缫�ϵĵ缫��ӦʽΪ ����Y�缫�����۲쵽��ʵ�������� ������õ缫��Ӧ����ķ����� ��
��X�缫�ϵĵ缫��ӦʽΪ ��
��2����Ҫ�õ�ⷽ���������������Һaѡ��Ni(NO3)2��Һ����
��X�缫�IJ����� ���缫��ӦʽΪ ��
��Y���IJ����� ���缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� [���ʽṹ������]
������O3����[Fe(H2O)6]2+�����ܽ������е�SO2��NOx�ֱ�����Ϊ![]() ��
��![]() ��NOxҲ�������������±���ԭΪN2��
��NOxҲ�������������±���ԭΪN2��
��1��![]() ����ԭ�ӹ�����ӻ�����Ϊ___________��
����ԭ�ӹ�����ӻ�����Ϊ___________��![]() �Ŀռ乹��Ϊ_____________����������������
�Ŀռ乹��Ϊ_____________����������������
��2��Fe2+��̬��������Ų�ʽΪ__________________��
��3����O3���ӻ�Ϊ�ȵ������һ��������Ϊ_____________���ѧʽ����
��4��N2��������������������Ŀ��n���ң���n���У�=__________________��
��5��[Fe(H2O)6]2+��NO��Ӧ���ɵ�[Fe(NO)(H2O)5]2+�У�NO��Nԭ����Fe2+�γ���λ��������[Fe(NO)(H2O)5]2+�ṹʾ��ͼ����Ӧλ�ò���ȱ�ٵ����塣
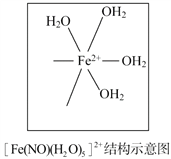
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com