
【题目】铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为_______________________。
(2)以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
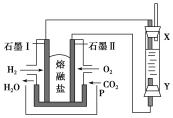
①石墨Ⅰ电极上的电极反应式为________________________________。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是________(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作电解液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为______________________________,该反应的化学方程式为________________________________________。
【答案】(1)2Fe3++Cu===2Fe2++Cu2+
(2)①H2-2e-+CO![]() ===CO2+H2O ②BC ③白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O===4Fe(OH)3
===CO2+H2O ②BC ③白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】(2)①书写石墨Ⅰ电极反应式时,要注意负极产物H+与熔融碳酸盐中的CO![]() 反应生成H2O和CO2。②A项,只需Y端的阳极用铁作电极,错误;B项,电解质溶液可以选用NaOH、Na2SO4溶液等,正确;C项,水电离出的H+在阴极上放电,正确;D项,若选用FeCl2溶液作电解液,白色沉淀可在阴极上产生,错误。③Fe(OH)2具有强还原性,暴露在空气中易被氧气氧化成Fe(OH)3。
反应生成H2O和CO2。②A项,只需Y端的阳极用铁作电极,错误;B项,电解质溶液可以选用NaOH、Na2SO4溶液等,正确;C项,水电离出的H+在阴极上放电,正确;D项,若选用FeCl2溶液作电解液,白色沉淀可在阴极上产生,错误。③Fe(OH)2具有强还原性,暴露在空气中易被氧气氧化成Fe(OH)3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】147 g H2SO4的物质的量是______;0.5 mol H2SO4的质量是______;其中含有_____mol H,含有_____mol O;2 mol H2SO4 中含有H2SO4分子数为______个,含有氢原子数为_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生3A+B = 2C (均为气体)的反应,若最初加入A和B都是4mol, A的平均反应速率是0.12mol/(L.s),则10s后容器中的B的物质的量是
A、1.6mol B、3.2mol C、3.6mol D、2.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用H2和N2直接合成氨:N2+3H2=2NH3,下列措施肯定能使合成氨反应速率加快的是:
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强
A.只有①②③ B.只有①②④ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应速率、反应限度的下列说法中错误的是
A.其它条件不变时,升高温度化学反应速率加快
B.其它条件不变时,增大浓度化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
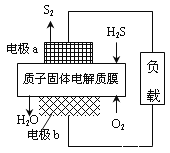
A. 电池工作时,电流从电极a经负载流向电极b
B. 电极a上发生的电极反应为:2H2S - 4e-=S2 + 4H+
C. 当反应生成64gS2时,电池内部释放632kJ热能
D. 当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各有机物的说法不正确的是
A. 乙烯可使溴的四氯化碳溶液褪色B. 乙醇可与金属Na发生置换反应
C. 苯可使酸性KMnO4溶液褪色D. 乙酸的酸性比碳酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH3→CH3CH2Cl→CH2 = CH2→CH3CH2OH的转化过程中,经过的反应是
A.取代→消去→加成 B.裂解→取代→消去
C.取代→加成→氧化 D.取代→消去→水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com