
| A. | 由水电离产生的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 室温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+ | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
分析 A.由水电离产生的c(H+)=1×10-12 mol•L-1的溶液,为酸或碱溶液;
B.离子之间相互促进水解;
C.加酚酞呈红色的溶液,显碱性;
D.c(H+)/c(OH-)=1012的溶液,显酸性.
解答 解:A.由水电离产生的c(H+)=1×10-12 mol•L-1的溶液,为酸或碱溶液,碱溶液中不能大量存在Fe2+,酸溶液中H+、Fe2+、NO3-发生氧化还原反应不能共存,故A不选;
B.Al3+、HCO3-相互促进水解,不能共存,故B不选;
C.加酚酞呈红色的溶液,显碱性,不能大量存在NH4+,故C不选;
D.c(H+)/c(OH-)=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4,酸性KMnO4溶液 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 澄清的石灰水,浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
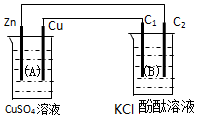 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油存放过久,会有一种难闻的“哈喇”味,但不影响食用 | |
| B. | 葡萄糖能发生水解反应 | |
| C. | 淀粉和纤维素水解的最终产物是葡萄糖 | |
| D. | 氨基酸分子中含有氨基和羧基,因此具有两性,但蛋白质没有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com