
ЁОЬтФПЁПвдAКЭBЮЊдСЯКЯГЩБтЬвЫсбмЩњЮяFЕФТЗЯпШчЭМЫљЪОЃК

ЃЈ1ЃЉAЗжзгЪНЮЊC2H2O3ЃЌПЩЗЂЩњвјОЕЗДгІЃЌЧвОпгаЫсадЃЌAЫљКЌЙйФмЭХУћГЦЮЊ__________ЃЛ
ЃЈ2ЃЉA+BCЕФЗДгІРраЭЮЊ_______ЃЌAЕФЫЎШмвКгызуСПаТжЦЧтбѕЛЏЭаќзЧвКЙВШШ,ЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЃЛC( )жаЪжадЬМдзгЫљСЌНгЕФєЧЛљдкЂйЂкЂлжаЫсадзю_______ЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
)жаЪжадЬМдзгЫљСЌНгЕФєЧЛљдкЂйЂкЂлжаЫсадзю_______ЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЁЃ
ЃЈ3ЃЉBЗжзгжазюЖрга_______ИідзгЙВУцЃЌЯђBЕФЫЎШмвКжаЕЮМгХЈфхЫЎЃЌЯжЯѓ_______ЃЛFдкМгШШЬѕМўЯТгызуСПNaOHШмвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЃЛ
ЃЈ4ЃЉEЪЧгЩ2ЗжзгCЩњГЩЕФКЌга3ИіСљдЊЛЗЕФЛЏКЯЮяЃЌEЗжзгЕФНсЙЙМђЪНЮЊ_______ЃЛ
ЃЈ5ЃЉдкЗћКЯЯТСаЬѕМўЕФFЕФЭЌЗжвьЙЙЬх(ВЛПМТЧСЂЬхвьЙЙ)жаЃЌКЫДХЙВеёЧтЦзгаЮхзщЗхЕФЮяжЪЕФНсЙЙМђЪНЮЊ____________
ЂйЪєгквЛдЊЫсРрЛЏКЯЮяЃЛЂкБНЛЗЩЯжЛга2ИіШЁДњЛљЧвДІгкЖдЮЛЃЌЦфжавЛИіЪЧєЧЛљЁЃ
ЃЈ6ЃЉвбжЊЃК![]() ЃЌAгаЖржжКЯГЩЗНЗЈЃЌдкЗНПђжааДГігЩввЫсКЯГЩAЕФТЗЯпСїГЬЭМ(ЦфЫћдСЯШЮбЁ)ЁЃ_______
ЃЌAгаЖржжКЯГЩЗНЗЈЃЌдкЗНПђжааДГігЩввЫсКЯГЩAЕФТЗЯпСїГЬЭМ(ЦфЫћдСЯШЮбЁ)ЁЃ_______
ЁОД№АИЁПШЉЛљЁЂєШЛљ МгГЩЗДгІ OHC-COOH+2Cu(OH)2+2NaOH![]() NaOOC-COONa+Cu2OЁ§+4H2O Шѕ 13 ВњЩњАзЩЋГСЕэ
NaOOC-COONa+Cu2OЁ§+4H2O Шѕ 13 ВњЩњАзЩЋГСЕэ  +3NaOHЁњ
+3NaOHЁњ +CH3OH+NaBr+H2O
+CH3OH+NaBr+H2O 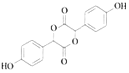
 CH3COOH
CH3COOH![]() ClCH2COOH
ClCH2COOH![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHC-COOH
OHC-COOH
ЁОНтЮіЁП
AЕФЗжзгЪНЮЊC2H2O3ЃЌПЩЗЂЩњвјОЕЗДгІЃЌЧвОпгаЫсадЃЌЫЕУїКЌгаШЉЛљКЭєШЛљЃЌдђAЕФНсЙЙжЛФмЮЊOHC-COOHЃЛИљОнCЕФНсЙЙПЩжЊBЪЧ![]() ЁЃ
ЁЃ
(1)AЫљКЌЙйФмЭХЮЊШЉЛљКЭєШЛљЃЛ
(2)AЕНBЕФЙ§ГЬжаAжаЬМбѕЫЋМќДђПЊЃЌЗжБ№СЌНгБНЛЗКЭЧтдзгЃЌЮЊМгГЩЗДгІЃЛаТжЦЧтбѕЛЏЭаќзЧвКжагаЙ§СПЕФNaOHПЩвдгыAжаєШЛљЗДгІЃЌМгШШЬѕМўЯТаТжЦЧтбѕЛЏЭгжФмбѕЛЏAжаШЉЛљЩњГЩєШЛљЃЌдйКЭNaOHЗДгІЃЌЫљвдЗНГЬЪНЮЊOHC-COOH+2Cu(OH)2+2NaOH![]() NaOOC-COONa+Cu2OЁ§+4H2OЃЛCжаЪжадЬМдзгЮЊЂкКХєЧЛљЫљСЌЬМдзгЃЌЂйКХєЧЛљЪмБНЛЗгАЯьЫсадНЯЧПЃЌЂлКХєЧЛљЮЊєШЛљжаЕФєЧЛљЃЌЫсадзюЧПЃЌЂкКХєЧЛљЫсадзюШѕЃЛ
NaOOC-COONa+Cu2OЁ§+4H2OЃЛCжаЪжадЬМдзгЮЊЂкКХєЧЛљЫљСЌЬМдзгЃЌЂйКХєЧЛљЪмБНЛЗгАЯьЫсадНЯЧПЃЌЂлКХєЧЛљЮЊєШЛљжаЕФєЧЛљЃЌЫсадзюЧПЃЌЂкКХєЧЛљЫсадзюШѕЃЛ
(3)BЮЊ![]() ЃЌБНЛЗЩЯ12ИідзгШЋВПЙВУцЃЌбѕЧтЕЅМќПЩвда§зЊЃЌЫљвдзюЖрга13ИідзгЙВУцЃЛБНЗгПЩвдКЭХЈфхЫЎЗЂЩњШЁДњЗДгІЩњГЩВЛШмгкЫЎЕФ2,4,6Ш§фхБНЗгЃЌЫљвдЯжЯѓЮЊВњЩњАзЩЋГСЕэЃЛFжафхдзгдкNaOHЫЎШмвКЗЂЩњЫЎНтЃЌЗгєЧЛљПЩвдКЭNaOHЗДгІЃЌѕЅЛљЫЎНтЩњГЩєШЛљПЩвдКЭNaOHЗДгІЃЌЫљвдЗДгІЗНГЬЪНЮЊЃК
ЃЌБНЛЗЩЯ12ИідзгШЋВПЙВУцЃЌбѕЧтЕЅМќПЩвда§зЊЃЌЫљвдзюЖрга13ИідзгЙВУцЃЛБНЗгПЩвдКЭХЈфхЫЎЗЂЩњШЁДњЗДгІЩњГЩВЛШмгкЫЎЕФ2,4,6Ш§фхБНЗгЃЌЫљвдЯжЯѓЮЊВњЩњАзЩЋГСЕэЃЛFжафхдзгдкNaOHЫЎШмвКЗЂЩњЫЎНтЃЌЗгєЧЛљПЩвдКЭNaOHЗДгІЃЌѕЅЛљЫЎНтЩњГЩєШЛљПЩвдКЭNaOHЗДгІЃЌЫљвдЗДгІЗНГЬЪНЮЊЃК +3NaOHЁњ
+3NaOHЁњ +CH3OH+NaBr+H2OЃЛ
+CH3OH+NaBr+H2OЃЛ
(4)CжагаєЧЛљКЭєШЛљЃЌ2ЗжзгCПЩвдЗЂЩњЗжзгМфѕЅЛЏЗДгІЃЌПЩвдЩњГЩ3ИіСљдЊЛЗЕФЛЏКЯЮяЃЌдђEЮЊ ЃЛ
ЃЛ
(5)FЮЊ ЃЌЦфЭЌЗжвьЙЙЬхТњзуЃКЂйЪєгквЛдЊЫсРрЛЏКЯЮяЃЌЫљвдКЌгавЛИієШЛљЃЛЂкБНЛЗЩЯжЛга2ИіШЁДњЛљЧвДІгкЖдЮЛЃЌЦфжавЛИіЪЧєЧЛљЃЌдђСэвЛИіШЁДњЛљЮЊЃК-CBr(CH3)COOHЁЂ-CH(CH2Br)COOHЁЂ-CH2CHBrCOOHЁЂ-CHBrCH2COOHЃЌКЫДХЙВеёЧтЦзгаЮхзщЗхЕФЮЊ
ЃЌЦфЭЌЗжвьЙЙЬхТњзуЃКЂйЪєгквЛдЊЫсРрЛЏКЯЮяЃЌЫљвдКЌгавЛИієШЛљЃЛЂкБНЛЗЩЯжЛга2ИіШЁДњЛљЧвДІгкЖдЮЛЃЌЦфжавЛИіЪЧєЧЛљЃЌдђСэвЛИіШЁДњЛљЮЊЃК-CBr(CH3)COOHЁЂ-CH(CH2Br)COOHЁЂ-CH2CHBrCOOHЁЂ-CHBrCH2COOHЃЌКЫДХЙВеёЧтЦзгаЮхзщЗхЕФЮЊ ЃЛ
ЃЛ
(6)ЖдБШCH3COOHКЭOHC-COOHПЩжЊЃЌашвЊНЋввЫсжаЕФМзЛљзЊЛЏЮЊШЉЛљЃЌШЉЛљПЩвдгЩєЧЛљбѕЛЏЩњГЩЃЌТБдзгПЩвдЫЎНтЩњГЩєЧЛљЃЌИљОнЬтФПЫљИјаХЯЂПЩжЊввЫсжаЕФМзЛљдкPCl3/МгШШЬѕМўЯТЗДгІЩњГЩТБдзгЃЌЫљвдКЯГЩТЗЯпЮЊЃКCH3COOH![]() ClCH2COOH
ClCH2COOH![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHC-COOHЁЃ
OHC-COOHЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЇЗШЫс(ШчЭМ)ЃЌДцдкгкаэЖржавЉЃЌШчвАКњТмВЗЁЂЙтвЖЫЎЫеЁЂмёТѓЕШжаЁЃПЇЗШЫсгажЙбЊзїгУЁЃЯТСаЙигкПЇЗШЫсЕФЫЕЗЈВЛе§ШЗЕФЪЧ
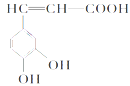
A.ПЇЗШЫсЕФЗжзгЪНЮЊC9H8O4
B.1 molПЇЗШЫсПЩвдКЭКЌ4 molBr2ЕФХЈфхЫЎЗДгІ
C.1 molПЇЗШЫсгызуСПNaHCO3ШмвКЗДгІФмВњЩњБъПіЯТдМ67.2LЕФCO2
D.ВЛПЩвдгУИпУЬЫсМиМьбщПЇЗШЫсЗжзгжаЕФЬМЬМЫЋМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГШ§дЊєШЫс H3A дкБэУцЛюадМСЁЂЯДЕгМСЁЂШѓЛЌМСЕШЗНУцОпгаживЊЕФЕиЮЛЁЃГЃЮТЪБЃЌЯђ 10 mL 0.01 molЁЄL1 ЕФ H3A ШмвКжаЕЮШы 0.01 molЁЄL1 ЕФ NaOH ШмвКЃЌH3AЁЂH2AЁЂHA2ЁЂA3ЕФЮяжЪЕФСПЗжЪ§гыШмвКЕФ pH ЕФЙиЯЕШч ЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ( )
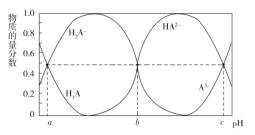
A.ИУЮТЖШЯТЃЌH3A ЕФЕчРыГЃЪ§ Ka1=10a
B.Шє b=7ЃЌМгШы 20 mL NaOH ШмвКЪБЃЌШмвКЕФ pHЃМ7
C.NaOH ШмвКЕФЬхЛ§ЮЊ 30 mL ЪБЃЌШмвКжаЃКc(OH)=3c(H3A)ЃЋ2c(H2A)ЃЋc(HA2)ЃЋc(H+)
D.ЗДгІ 2H2A![]() H3AЃЋHA2дкИУЮТЖШЯТЕФЦНКтГЃЪ§K=10a-b
H3AЃЋHA2дкИУЮТЖШЯТЕФЦНКтГЃЪ§K=10a-b
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђКЌгаamol AlCl3ШмвКжаМгШыКЌгаbmol KOHШмвКЃЌЩњГЩГСЕэЕФЮяжЪЕФСППЩФмЪЧ
Ђйamol Ђкbmol Ђлa/3mol Ђмb/3mol Ђн0 mol Ђо(4a-b)mol
A.ЂйЂлЂмЂнЂоB.ЂйЂкЂлЂмЂнC.ЂйЂмЂнЂоD.ЂйЂмЂн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ20mL0.1molLЉ1ЕФH2AЃЈЖўдЊШѕЫсЃЉШмвКжаЕЮМг0.1mol/LЕФNaOHШмвКЃЌШмвКpHЫцNaOHШмвКЬхЛ§ЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
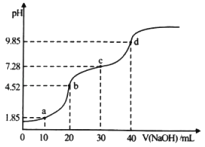
A.aЕуЕФШмвКжаЃКcЃЈNa+ЃЉЃОcЃЈA2ЃЉЃОcЃЈHAЃЉЃОcЃЈH+ЃЉЃОcЃЈOHЃЉ
B.bЕуЕФШмвКжаЃКcЃЈH2AЃЉ+cЃЈH+ЃЉЃНcЃЈA2ЃЉ+cЃЈOHЃЉ
C.cЕуШмвКЕФpHЃО7ЃЌЪЧвђЮЊДЫЪБHAЕФЕчРыФмСІаЁгкЦфЫЎНтФмСІ
D.ШєНЋ0.1molLЉ1ЕФNaOHШмвКЛЛГЩЭЌХЈЖШЕФАБЫЎЃЌЕБЕЮМг40mLЪБЃЌДЫЪБШмвКЕФpHЃО9.85
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬњЪЧгІгУзюЙуЗКЕФН№ЪєЃЌЬњЕФТШЛЏЮяЁЂбѕЛЏЮявдМАИпМлЬњЕФКЌбѕЫсбЮОљЮЊживЊЛЏКЯЮяЁЃ
ЃЈ1ЃЉдкЪЕбщЪвжаЃЌFeCl2ПЩгУЬњЗлКЭ___(ЬюУћГЦ)ЗДгІжЦБИЁЃ
ЃЈ2ЃЉFe3O4ПЩгУЖржжЗНЗЈжЦЕУЃЌЦфжагЩвЛжжЕЅжЪКЭвЛжжЛЏКЯЮяЭЈЙ§ЛЏКЯЗДгІжЦБИЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃ
ЃЈ3ЃЉЪЕбщЪвдкжЦБИFe(OH)2ЪББиаыИєОјПеЦјЃЌЗёдђЗЂЩњЕФЯжЯѓЪЧ___ЃЌЖдгІЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃ
ЃЈ4ЃЉКьзЉЪЧгУ№ЄЭСИпЮТЩеНсЖјГЩЕФЃЌвђЦфКЌгаFe2O3ГЪКьЩЋЛђзиКьЩЋЖјЕУУћЃЌГЃгУзїНЈжўВФСЯЁЃЧыЩшМЦвЛИіМђЕЅЪЕбщжЄУїКьзЉжаКЌгаFe3+ЃК___ЁЃ
ЃЈ5ЃЉЯжгавЛКЌгаFeCl2КЭFeCl3ЕФЛьКЯЮябљЦЗЃЌЪЕбщВтЕУn(Fe)ЃКn(C1)=1ЃК2.1ЃЌдђИУбљЦЗжаFeCl3ЕФЮяжЪЕФСПЗжЪ§ЮЊ___ЁЃ
ЃЈ6ЃЉИпЬњЫсМи(K2FeO4)ЪЧвЛжжЧПбѕЛЏМСЃЌПЩзїЮЊЫЎДІРэМСКЭИпШнСПЕчГиВФСЯЁЃFeCl3КЭKClOдкЧПМюадЬѕМўЯТЗДгІПЩжЦШЁK2FeO4ЃЌЦфЗДгІЕФРызгЗНГЬЪНЮЊЃК___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЙЄГЇЕФЙЄвЕЗЯЫЎжаКЌгаДѓСПЕФFeSO4КЭНЯЖрЕФCu2+ЁЃЮЊСЫМѕЩйЮлШОБфЗЯЮЊБІЃЌЙЄГЇМЦЛЎДгИУЗЯЫЎжаЛиЪеСђЫсбЧЬњКЭН№ЪєЭЁЃЧыИљОнСїГЬЭМЃЈШчЭМЃЉЃЌЛиД№ЯТСаЮЪЬтЁЃ

ЃЈ1ЃЉВйзїЂёжаЫљгУЕФвЧЦїга____ЁЃ
ЃЈ2ЃЉЙЬЬхAЕФГЩЗжЪЧ___КЭ____ЁЃЃЈЬюУћГЦЃЉЃЛВйзїЂѓЪЧ____ЁЃ
ЃЈ3ЃЉШчКЮМьбщШмвКaжажївЊвѕРызг____ЁЃ
ЃЈ4ЃЉЛиЪеЕФЭПЩвдгУгкжЦБИЕЈЗЏЃЈCuSO4ЁЄ5H2OЃЉЁЃНЋЭКЭ0.22mol/LH2SO4ШмвКЛьКЯКѓЃЌдкМгШШЕФЧщПіЯТВЛЖЯЭЈШыбѕЦјОЭПЩвджЦЕУCuSO4ЃЌШЛКѓНЋЫљЕУЕФШмвКОЙ§ЁАвЛЯЕСаВйзїЁБКѓЕУЕНЕЈЗЏЁЃаДГіЩњГЩCuSO4ЕФЛЏбЇЗНГЬЪНЃК___ЁЃ
ЃЈ5ЃЉФГЭЌбЇгУУмЖШЮЊ1.84g/cm3ЁЂжЪСПЗжЪ§ЮЊ 98%ЕФХЈСђХфжЦ500mL0.22mol/LЕФЯЁСђЫсШмвКЃЌашвЊгУЙцИёЮЊ___mLЕФСПЭВСПШЁ___mLЕФХЈСђЫсЁЃ
ЃЈ6ЃЉХфжЦИУШмвКЕФЙ§ГЬжаЃЌЯТСаВйзїЪЙЕУЫљХфЕУЕФШмвКХЈЖШЦЋаЁЕФЪЧ___(ЬюзжФИ)ЁЃ
AЃЎЯЁЪЭУмЖШЮЊ1.84g/cm3ЁЂжЪСПЗжЪ§ЮЊ 98%ЕФХЈСђЫсЪБЃЌВЛаЁаФНІГіЩйСПСђЫсШмвК
BЃЎгУеєСѓЫЎЯДЕгЩеБЁЂСПЭВМАВЃСЇАєЃЌВЂНЋЯДЕгвКзЂШыШнСПЦПжа
CЃЎЖЈШнЪБЗДИДЩЯЯТЕЙзЊШнСПЦПКѓЃЌЗЂЯжАМвКУцзюЕЭДІЕЭгкПЬЖШЯпЃЌдйВЙМгЫЎЕНПЬЖШЯп
DЃЎСПШЁУмЖШЮЊ1.84g/cm3ЁЂжЪСПЗжЪ§ЮЊ 98%ЕФХЈСђЫсЪБЃЌбіЪгСПЭВЕФПЬЖШЯп
EЃЎЯДЕгШнСПЦПКѓЃЌСЂМДгУРДХфжЦШмвК
FЃЎЯЁЪЭХЈСђЫсНсЪјКѓСЂМДНЋШмвКзЊвЦЕНШнСПЦПжа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ3CuO+2NH3![]() 3Cu+N2+3H2OЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
3Cu+N2+3H2OЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
A.NдЊЫиЕФЛЏКЯМлНЕЕЭB.NH3БЛЛЙд
C.ЯћКФ0.3 mol CuOзЊвЦ0.6 NAИіЕчзгD.CuOЪЧЛЙдМС
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЫЎдк25 ЁцКЭ95 ЁцЪБЕФЕчРыЦНКтЧњЯпШчЭМЫљЪОЃК
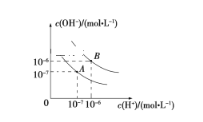
ЃЈ1ЃЉ25 ЁцЪБЫЎЕФЕчРыЦНКтЧњЯпгІЮЊ__________ (ЬюЁАAЁБЛђЁАBЁБ)ЁЃ
ЃЈ2ЃЉ95 ЁцЪБЫЎЕФРызгЛ§Kw=__________ЃЌcHЃЋ==__________
ЃЈ3ЃЉ25 ЁцЪБЃЌНЋpH=9ЕФNaOHШмвКгыpH=4ЕФH2SO4ШмвКЛьКЯЃЌШєЫљЕУЛьКЯШмвКЕФpH=7ЃЌдђNaOHШмвКгыH2SO4ШмвКЕФЬхЛ§БШЮЊ_____ЁЃ
ЃЈ4ЃЉ95 ЁцЪБЃЌШє100 mL pH1=aЕФФГЧПЫсШмвКгы1 mL pH2=bЕФФГЧПМюШмвКЛьКЯКѓЃЌЫљЕУШмвКГЪжаадЃЌдђЛьКЯЧАЃЌИУЧПЫсЕФpH1гыЧПМюЕФpH2жЎМфгІТњзуЕФЙиЯЕЪЧ____ЁЃ
ЃЈ5ЃЉдкЧњЯпBЖдгІЕФЮТЖШЯТЃЌНЋpH=2ЕФФГHAШмвККЭpH=10ЕФNaOHШмвКЕШЬхЛ§ЛьКЯЃЌЫљЕУШмвКЕФpH=5ЁЃЧыЗжЮіЦфдвђЃК_________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com