
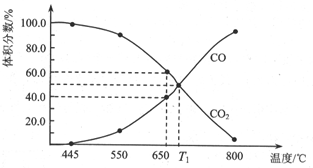
 一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据C和CO的燃烧热书写热化学方程式,根据已知热化学方程式构建目标方程式,根据盖斯定律计算C(s)+CO2(g)?2CO(g)的△H;
(2)根据差量法求出生成的CO的物质的量,然后根据V=$\frac{△n}{\frac{v}{△t}}$求出反应的速率;
(3)①由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
②反应前压强为ρkPa,分压=总压×物质的量分数,根据反应后的物质的量分数计算T1℃的平衡常数Kp,T1℃时Qp=Kp,平衡不移动;
③C(s)+CO2(g)?2CO(g),△v=气态产物的化学计量数之和-气态反应物的化学计量数之和=1,根据Kp=Kc(RT)△v,代入相关数据即可解得此时的热力学温度.
解答 解:(1)C和CO的燃烧热分别为393KJ•mol-1、283KJ•mol-1,依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,反应的热化学方程式分别为:
①C(s)+O2(g)→CO2(g)△H=-393KJ/mol,②2CO(g)+O2(g)→2CO2(g)△H=-566KJ/mol,将①-②得到C(s)+CO2(g)?2CO(g),根据盖斯定律
△H=(-393KJ/mol)-(-566KJ/mol)=+173KJ/mol,
故答案为:+173KJ/mol;
(2)假设体积为1L,测得容器内的密度增大了2.4g•L-1,C(s)+CO2(g)?2CO(g)△m
12 44 56 12
m 2.4g
$\frac{56}{m}=\frac{12}{2.4g}$ 解得m=11.2g,n=$\frac{m}{M}$=$\frac{11.2g}{28g/mol}$=0.4mol,则10s内用CO表示的平均反应速率为V=$\frac{△n}{\frac{v}{△t}}$=$\frac{0.4mol}{\frac{1L}{10S}}$=0.04mol/(L•s),
故答案为:0.04mol/(L•s);
(3)①由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为:$\frac{0.25}{1}$×100%=25%,
故答案为:25%;
②若将反应容器改为容积可变的恒压密闭容器,压强为ρkPa,由图可知,T1℃时,反应达平衡后CO和CO2的体积分数都为50%,分压=总压×物质的量分数,T1℃时平衡Kp=0.5ρkPa,由图可知,T1℃时,反应达平衡后CO和CO2的体积分数都为50%为平衡状态,该温度下达平衡后若再充入等物质的量的CO和CO2气体,Qp=Kp,则平衡不移动,
故答案为:0.5pka;不;Qp=Kp;
③C(s)+CO2(g)?2CO(g),△v=气态产物的化学计量数之和-气态反应物的化学计量数之和=2-1=1,Kp=Kc(RT)△v,其中R=8.314L•kPa•mol-1•K-1,$\frac{{K}_{p}}{{K}_{c}}$的值为9976.8,△v=1,分别代入得:Kp=$\frac{9976.8}{8.314}$=1200,
故答案为:1200.
点评 本题考查了化学平衡的计算、阅读题目获取信息的能力等,需要学生具备运用信息与基础知识分析问题、解决问题的能力,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:选择题
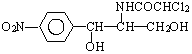 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团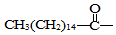 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的盐类 | B. | 它不是棕榈酸的酯类 | ||
| C. | 它的水溶性变差,所以苦味消失 | D. | 它的水溶性变良,所以苦味消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| C. | 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废弃的饮料包装纸,制作成公园内的休闲长椅 | |
| B. | 大力开发丰富的煤炭资源,减少对石油的依赖 | |
| C. | 在西部和沿海地区兴建风力发电站,解决能源问题 | |
| D. | 鼓励购买小排量汽车,推广电动、混合动力汽车 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
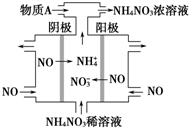 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
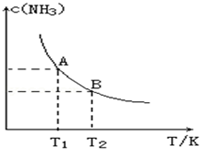 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═SO42-+4H++2Fe2+ | B. | 2Br-+SO42-+4H+═SO2+Br2+2H2O | ||
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com