
分析 (1)在水溶液中和熔融状态下均不能导电的化合物为非电解质,据此分析;
(2)在水溶液中或熔融状态下能导电的化合物为电解质,据此分析;
(3)根据电解质的结构来分析.
解答 解:①NaHCO3晶体溶于水后能导电,故为电解质;②液态SO3在水溶液中能导电和其本身无关,在熔融状态下又不导电,故为非电解质;③HF溶于水后能导电,故为电解质;④盐酸是混合物,既不是电解质也不是非电解质;⑤蔗糖在水溶液中和熔融状态下均不导电,故为非电解质;⑥铜是单质,既不是电解质也不是非电解质;⑦KOH固体在水溶液中和熔融状态下均能导电,故为电解质;⑧氨水是混合物,既不是电解质也不是非电解质.
(1)在水溶液中和熔融状态下均不能导电的化合物为非电解质,故为非电解质的为②⑤,故答案为:②⑤;
(2)在水溶液中或熔融状态下能导电的化合物为电解质,故为电解质的是①③⑦,故答案为:①③⑦;
(3)碳酸氢钠属于强电解质,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-;
HF是弱酸,电离离子方程式为:HF?H++F-;
KOH为强电解质,在溶液中能完全电离,电离方程式为:KOH=K++OH-;
故答案为:NaHCO3═Na++HCO3-;HF?H++F-;KOH=K++OH-.
点评 本题考查了电解质、非电解质的概念区分以及电离方程式的书写,难度不大,应注意的是电解质和非电解质均为化合物.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,再移走酒精灯停止加热 | |
| B. | 蒸馏实验中,温度计的水银球应插入液态混合物中 | |
| C. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| D. | 蒸馏时,蒸馏时冷凝水从冷凝管下口进上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
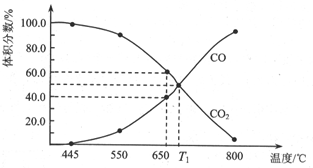 一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
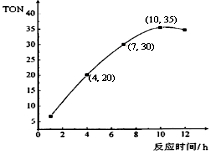 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
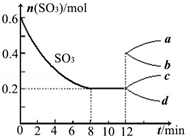 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下水由气态变为液态 | |
| B. | 高温高压条件下使石墨转化为金刚石 | |
| C. | 有序排列的火柴散落 | |
| D. | CO点燃时生成CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com