
| A��CO32-��Cl-һ�������� |
| B��A13+��NH4+һ������ |
| C��Mg2+һ�����ڣ�Al3+���ڿ��� |
| D��SO42-��Ũ����0.1mol?L-1 |
| 0.58g |
| 58g/mol |
| 6.99g |
| 233g/mol |
| 0.03mol |
| 0.1L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K+��Na+��Cl-��CO32- |
| B��Cu2+��Cl-��Na+��SO42- |
| C��Ca2+��Na+��Cl-��NO3- |
| D��Fe3+��NH4+��SCN-��HCO3-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
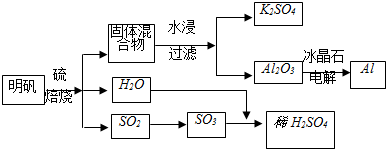
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
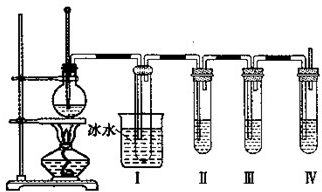 ʵ������ȡ��ϩ��������ϩ����ʵ���װ����ͼ��ʾ����ش�
ʵ������ȡ��ϩ��������ϩ����ʵ���װ����ͼ��ʾ����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ᴿ������ | �����Լ� | ���뷽�� | |
| A | �������������ᣩ | CCl4 | ��ȡ����Һ |
| B | ���飨��ϩ�� | ���������Һ | ϴ�� |
| C | �Ҵ������ᣩ | ���������� | ���� |
| D | �����壩 | �⻯����Һ | ��Һ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 Na2CO3��0.01molNaHCO3���ס����зֱ���10mL��ͬŨ�ȵ����ᣬ����������е�����ͬʱ������Ե��Թ��У�����������ȷ���ǣ�������
Na2CO3��0.01molNaHCO3���ס����зֱ���10mL��ͬŨ�ȵ����ᣬ����������е�����ͬʱ������Ե��Թ��У�����������ȷ���ǣ�������| A���������Թ���Na+��Cl-�����ʵ���һ����ͬ |
| B����װ�õ������������ʴ� |
| C�������������������ͬ���������Ũ��һ��С�ڻ����1mol/L |
| D�������������������ͬ���������Ũ��һ�����ڻ����2mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ȼ�Ļ�ѧ����Ǿ������ϩ |
| B��������ë���ںϳ���ά |
| C��ͨ����������ʹ�ṹ�����ͱ�����ͽṹ |
| D�����������ڸ��ϲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ع������ڻ���һЩ�������к������ʶ�����ʳ�ã��ɼӹ��Ƴ�������ͣ�������͵ijɷ����ʯ������ȡ�IJ��ͳɷ���ͬ |
| B�����ס������ֱ�����ˮ���γɵķ�ɢϵΪ���壬�ڼ��ȡ���ȩ�����ͣ�NH4��2SO4��X���������£������ʵ����ʶ���ı䲢�������� |
| C������ľ�ĵ���Ҫ�ɷֶ�����ά�أ���˿����ë����Ҫ�ɷֶ��ǵ����� |
| D��ʯ���ѽ����֬�������Ǹ߷�������С���ӵĹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��MgCl2��AlCl3�����Һ�У���ʼ�μ�7mL�Լ��ף�֮��õ��Լ��ң����ó���ymol���Լ����V��mL����Ĺ�ϵ��ͼ�����½���һ������ȷ���ǣ�������
��MgCl2��AlCl3�����Һ�У���ʼ�μ�7mL�Լ��ף�֮��õ��Լ��ң����ó���ymol���Լ����V��mL����Ĺ�ϵ��ͼ�����½���һ������ȷ���ǣ�������| A���������ᣬ����NaOH����C��NaOH��=2c��HCl�� |
| B��ԭ���Һ�У�C��Al3+����C��Mg2+����C��Cl-��=1��1��5 |
| C������NaOH���������ᣬ��C��NaOH����C��HCl��=2��1 |
| D����7��9mL����Ӧ���ӷ�ӦʽΪ��H++OH-=H2O |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com