
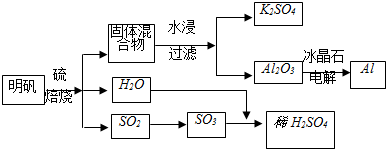
| ||
| ||
| 1 |
| 2 |
| 1058.4 |
| 1058.4+1080-194.4 |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
| 有机物 | 乙烯 | 乙炔 | 环已烷 | 苯 |
| Ω | 1 | 2 | 1 | 4 |
| A、1molΩ=3的不饱和链烃再结合6molH2即达到饱和 |
| B、C10H8的Ω=7 |
| C、C4H8的不饱和度与C3H6、C2H4的不饱和度不相同 |
| D、CH3CH2CH=CH2与环丁烷的不饱和度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、25℃,pH=7的NH3?H2O和NH4Cl的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| C、CH3COONa溶液中:c(Na+)>c(CH3COO -)>c(H+)>c(OH-) |
| D、NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用强光照射装满次氯酸的试管(倒置于水槽中),可收集到两种气体 |
| B、向漂白粉中加入稀盐酸可加强漂白效果 |
| C、漂白粉和次氯酸溶液都是纯净物 |
| D、氢气在氯气中燃烧生成白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-和Cl-一定不存在 |
| B、A13+和NH4+一定存在 |
| C、Mg2+一定存在,Al3+存在可能 |
| D、SO42-的浓度是0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com