
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。

(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
.已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.v(CO)=1.5mol·L-1·min-1
B.v(NO2)=0.7mol·L-1·min-1
C.v(N2)=0.4mol·L-1·min-1
D.v(CO2)=1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一上11月期中月考化学试卷(解析版) 题型:选择题
常温下,某100 mL溶液中含H2SO4 0.50 mol,加入下列物质,使溶液的导电性增强的是
A.0.50 mol Ba(OH)2
B.100 mL水
C.0.50 mol酒精
D.0.50 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
由下列反应:Cu+2FeCl3→2FeCl2+CuCl2,CuCl2+Fe→FeCl2+Cu,确定Fe2+、Fe3+、Cu2+的氧化性强弱顺序为
A、Fe2+>Cu2+>Fe3+
B、Fe3+>CU2+>Fe2+
C、Fe3+>Fe2+>Cu2+
D、Fe2+>Fe3+>Cu2+
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三11月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.用丁达尔现象可以区分乙醇溶液和淀粉溶液
B.16O转化为18O属于化学变化
C.实验室中,钠通常保存在盛有煤油的细口瓶中
D.定容时仰视容量瓶刻度线,所配制的NaOH溶液浓度将偏高
查看答案和解析>>
科目:高中化学 来源:2016届海南省等七校联盟高三第一次联考化学卷(解析版) 题型:选择题
《神农本草经》说:“水银……镕化(加热)还复为丹。”黄帝九鼎神丹经》 中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。这里的“丹”是指
A.氯化物 B.合金 C.硫化物 D.氧化物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一上学期期中考试化学试卷(解析版) 题型:选择题
溶液、胶体和浊液这三种分散系的根本区别是
A.是否是大量分子或离子的集合体
B.是否能通过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南衡阳第八中学高一上六科联赛化学卷(解析版) 题型:选择题
有下列三个反应:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br- ③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O。下列说法正确的是
A.①②③中的氧化产物分别是 I2、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性 Cl2>Fe3+>Co2O3
C.可以推理得到 Cl2+FeBr2═FeCl2+Br2
D.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:实验题
《化学反应原理》一书中,我们学习了两个重要的定量实验。请回答下列问题:
I.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1 NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实 验 试剂如下 | 溶 液 温 度 | 中和热 △H | ||||
t1 | t2 | |||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
已知:Q(放)=C m(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1·Kg-1,m指溶液的质量,各物质的密度均为1g·cm-3。
①计算分析△H= 。(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
II.为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为
(2) 完成并配平下列离子方程式
C2O42- + MnO4- + H+ = CO2 + Mn2+ +
(3) 步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(4) 步骤③中判断滴定终点的方法是 。
(5)常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示
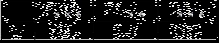
①写出H2C2O4的电离方程式_________ __________________。
②KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题) _______________
③向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
A.c K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
B.c(Na+) = c(H2C2O4) + c(C2O42-)
C.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
D.c(K+) > c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com