
《化学反应原理》一书中,我们学习了两个重要的定量实验。请回答下列问题:
I.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1 NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实 验 试剂如下 | 溶 液 温 度 | 中和热 △H | ||||
t1 | t2 | |||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
已知:Q(放)=C m(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1·Kg-1,m指溶液的质量,各物质的密度均为1g·cm-3。
①计算分析△H= 。(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
II.为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为
(2) 完成并配平下列离子方程式
C2O42- + MnO4- + H+ = CO2 + Mn2+ +
(3) 步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(4) 步骤③中判断滴定终点的方法是 。
(5)常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示
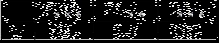
①写出H2C2O4的电离方程式_________ __________________。
②KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题) _______________
③向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
A.c K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
B.c(Na+) = c(H2C2O4) + c(C2O42-)
C.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
D.c(K+) > c(Na+)
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源:2016届湖北武汉华中师大一附中等八校高三上联考一理化学卷解析版 题型:填空题
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。

(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷(解析版) 题型:填空题
溴被称为“海洋元素”,海水中的溴主要以NaBr的形式存在。查阅资料得知:Br2的沸点为59℃,微溶于水,易溶于有机溶剂。实验室简单模拟从海水(此处以低浓度的NaBr溶液代替)中提取溴单质的流程如图:
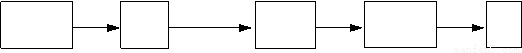

(1)写出实验操作的名称,操作① 、操作② ;
(2)在富集过程中,有反应 5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A.2NaBr+Cl2 = 2NaCl+Br2
B.2H2S+SO2 = 2H2O+3S↓
C.AlCl3+3NaAlO2+6H2O = 4Al(OH)3↓+3NaCl
D.Cl2 + 2NaOH = NaCl +NaClO + H2O
(3)实验前检测分液漏斗没有问题,但在操作①的步骤中,旋开分液漏斗下端的旋塞,却发现分液漏斗中的液体很难滴下,其原因可能是 ;
(4)下列说法正确的是 。
A.操作①中,可以用酒精代替CCl4
B.操作②中,若发现忘了加碎瓷片,应该趁热补加
C.操作②中,温度计水银球应浸没在蒸馏烧瓶中液体的液面以下,但不能接触瓶底
D.操作②中,冷凝水流向应该是下进上出
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三化学一诊模拟理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.1 mol CH4含有的电子数为NA
B.标准状况下,22.4 L 己烷中共价键数为19NA
C.6.4 g CaC2固体中所含阴离子数为0.2 NA
D.1 L 1 mol/L的NaHCO3 溶液中含有NA 个HCO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法
B.红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法
C.同位素示踪法是研究化学反应历程的手段之一
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B.太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源
C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少
D.由3O2(g)=2O3(g) ΔH>0,可知臭氧比氧气的化学性质更活泼
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东枣庄八中南校区高二12月月考化学卷(解析版) 题型:选择题
某温度下,在一定体积的密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表
 ,下列说法错误的是 ( )
,下列说法错误的是 ( )
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
 A.增大压强反应的平衡常数不变,但X的转化率增大
A.增大压强反应的平衡常数不变,但X的转化率增大
 B.该反应的化学方程式为:4X (g)+5Y (g)
B.该反应的化学方程式为:4X (g)+5Y (g) 4Z (g)+ 6W (g)
4Z (g)+ 6W (g)
 C.反应达到平衡时,X的转化率为80%
C.反应达到平衡时,X的转化率为80%
 D.其它条件不变,若增大Y的起始浓度,X的转化率增大
D.其它条件不变,若增大Y的起始浓度,X的转化率增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北冀州市高一上第四次月考化学试卷(解析版) 题型:选择题
ag 下列物质在氧气中充分燃烧后的气体(1.01×105Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重bg,符合b>a的( )
A.HCHO B.CH3OH C. HOOCCOOH D.纤维素(C6H10O5)n
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期月考(三)化学试卷(解析版) 题型:选择题
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,再向所得浊液中逐渐加入 1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。下列说法不正确的是( )
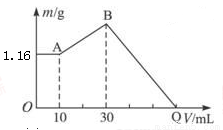
A.A点沉淀是Mg(OH)2
B.AB段发生的离子反应是AlO2-+H++H2O =Al(OH)3↓
C.原混合物中NaOH的质量是5.20g
D.Q点时耗用的HCl体积120ml
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com