
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是: 周期 族。
(2)A与C形成的18电子分子的结构式为: 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
A.B4沸点比P4(白磷)低,属于原子晶体
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| BA3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
(1)三 周期 ⅢA 族。(2分)
(2)H-O-O-H (2分)。
(3)CD(2分)
(4)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O(3分)
(5)2Al+3H2O-6e-=Al2O3+ 6H+(3分)
(6)2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=+1530kJ·mol—1(4分)
解析试题分析:A、B、C、D、E、F为H、N、O、Al、S、Fe,(2)A与C形成的18电子分子为双氧水,为共价化合物;(3)A.B4沸点比P4(白磷)低,是因为相对分子质量小,分子间作用力小,错误;B.l molB4气体转变为B2的△H=167×6-942×2=-882kJ·mol—1,是放出能量,错误;C.B4与B2互为同素异形体,正确;D.B4与B2分子中各原子最外电子层均达到8电子稳定结构,正确;(4)过量的铁生成硝酸亚铁;(5)铝失去电子生成氧化铝,2Al+3H2O-6e-=Al2O3+ 6H+;(6)生成1molBA3(g)和C2时的能量变化值为382.5kJ,再根据表中数据判断该反应为吸热反应,即得方程式2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=+1530kJ·mol—1。
考点:考查元素周期律与能量的变化等有关问题。


科目:高中化学 来源: 题型:填空题
现有部分前36号元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X | 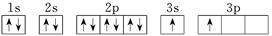 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,D ,E 。
② B、C的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出A2D的电离方程式: , 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。N P AS ;O S Se分别是VA族、VIA族连续三元素。
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,原子序数依次增大,有关信息如下。
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质既可与盐酸反应,又可与NaOH溶液反应 |
| E | 原子最外层电子数比次外层电子数少1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D代表4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,A元素的名称是 ,该元素的原子核外共有 种不同运动状态的电子;该元素的第一电离能比后面一号元素大的原因是 。
(2)B为元素周期表中的29号元素,常与H2O、NH3等形成配合物。
B的无水硫酸盐晶体呈 色,向盛有B的硫酸盐水溶液的试管里逐滴加入氨水,首先形成 ,继续添加氨水,沉淀溶解得到 ,写出后一步反应的离子方程式 。
(3)C元素的负一价离子的电子层结构与氩相同,C的最高价氧化物的水化物的化学式为 。
(4)A元素的最高价氧化物对应的水化物的稀溶液与29号元素的单质反应的离子方程式是____________________。
(5)D元素在元素周期表的各元素中,电负性仅小于氟,A的最低价氢化物与D的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)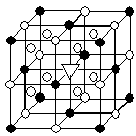
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com