
【题目】可以作为补血剂主要成份的物质是( )
A.小苏打B.绿矾C.氨基酸D.葡萄糖
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D、E均为有机化合物。己知:同温同压下,同质量的C和D的蒸汽所占体积相同,C不能发生催化氧化,D能与NaHCO3溶液发生反应。
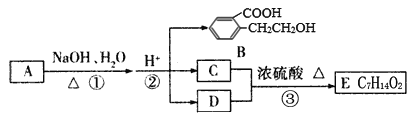
根据图示回答下列问题:
(1)C的名称是_____________________。
(2)化合物B能发生的反应是_______________。(填字母序号)
a.加成反应 b.氧化反应 c.消去反应 d.酯化反应 e.水解反应
(3)写出E的结构简式_______________。
(4)写出反应①的化学方程式:______________________________。
(5)同时符合下列三个条件的B的同分异构体有____________种,
a.苯环上有两个取代基且苯环上的一氯代物有两种
b.能与FeCl3溶液发生显色反应
c.能发生水解反应
其中能发生银镜反应的结构简式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种有机化合物的结构简式:(选填序号,下同)
①CH3CH═CH﹣CH2CH3 ② ③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥
③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥![]()
⑦CH3CH2CH2OCH3 ⑧![]() ⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
(1)互为同分异构体的是______________ (2)互为同系物的是___________
(3)官能团位置不同的同分异构体是_______ (4)官能团类型不同的同分异构体是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述符合的是

A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中![]() 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能够说明甲烷分子为正四面体结构,而不是平面正方形结构的是
A、甲烷分子中的C—H键完全相同
B、甲烷分子的结构具有对称性
C、甲烷分子的二氯代物只有一种结构
D、分子组成为CHCl3的物质具有固定的熔、沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
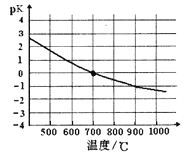
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com