
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
【答案】AD
【解析】A、Na2C2O4溶液的质子守恒,水电离出的n(H+)=n(OH-),在草酸钠水溶液中水电离出的氢离子以(H+,HC2O4-,H2C2O4)三种形式存在,其中1mol草酸分子中有2mol水电离出的氢离子,所以c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-),故A正确;B、b点时,溶液为NaHC2O4,根据物料守恒,c(Cl-)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故B错误;C、电荷守恒为c(Na+)=c(HC2O4-)+ c(C2O42-)×2+c(Cl-),故C错误;D、根据物料守恒,c(Na+ )=2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-),电荷守恒为c(H+)+c(Na+)=c(OH― )+c(HC2O4-)+ c(C2O42-)×2+c(Cl-),
2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-)+c(H+)=c(OH― )+c(HC2O4-)+ c(C2O42-)×2+c(Cl-)
即:2c(H2C2O4)+c(HC2O4-)+c(H+)=c(OH― )+c(Cl-),故c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)正确;故选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某无色透明溶液,可能含有下列离子:Mg2+、A13+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-。取该溶液进行如下实验:①取溶液少许,滴入AgNO3溶液产生白色沉淀;②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;③取一定量的原溶液,加入一种淡黄色粉末状的固体X,产生气体的物质的量(n气体)、沉淀的物质的量(n沉淀)与加入淡黄色粉末的量(nx)的关系如下图所示(假设生成的气体全部逸出)。

根据实验现象和数据分析正确的是
A. 溶液中肯定大量存在的阳离子只有Mg2+、A13+、NH4+
B. 溶液中肯定没有的离子只有Fe3+、Ba2+
C. 当加入0.6mol淡黄色粉末时,生成两种气体分别为NH3和O2,其对应的体积比为2:3
D. 溶液中可能存在Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可以提取到莽草酸,莽草酸有抗炎、镇痛作用,是合成某些抗癌药物的中间体。莽草酸的分子结构模型如图所示(分子中只有C、H、O三种原子)。下列有关莽草酸结构、性质叙述正确的是( )

A. 与氢气加成反应消耗氢气的物质的量为4mol.
B. 不能使溴水褪色,但能与氢气发生加成反应
C. 分子中同时含有羧基、羟基、碳碳双键三种官能团
D. 能与氯化铁溶液反应,溶液呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产、生活中有广泛应用,下列对应关系不正确的是
化学性质 | 实际应用 | |
A | SO2具有漂白性 | 用SO2漂白纸浆 |
B | Fe3+水解生成胶体 | 硫酸铁可用作净水剂 |
C | 维生素C易被氧气氧化 | 维生素C用作食品抗氧化剂 |
D | 硫酸是一种强酸 | 硫酸可用于除去锅炉中的水垢 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为 ![]() 。
。
异戊二烯的一种制备方法如图所示:
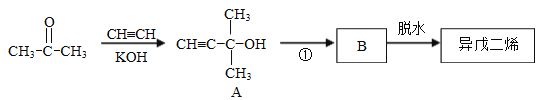
请回答:
(1)A分子中官能团的名称是_______。
(2)①的反应类型是_______。
(3)B的结构简式为___________________________。
(4)写出在一定条件下由异戊二烯制备聚异戊二烯的化学方程式_____________。
(5)设计一条由异戊二烯制得有机合成中间体![]() 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】左乙拉西坦(物质G)是一种治疗癫痫的药物,可通过以下方法合成:

(1)B中的含氧官能团名称为_______。
(2)E→F的反应类型为_________。
(3)X的分子式为C4H7ON,写出X的结构简式:____________。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:________。
① 能发生水解反应,水解产物仅有一种,且为α-氨基酸;
② 分子中含六元环结构,且有4种不同化学环境的氢。
(5)请以![]() 和
和![]() 为原料制备
为原料制备 ,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )

A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g·cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇。实验室中由甲苯(式量:92,密度为0.8669 g·cm-3)制备苯甲酸的实验如下:
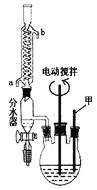
第一步:将18.4g甲苯和硫酸酸化的KMnO4溶液置于如图的三颈瓶中,加热保持反应物溶液温度在90℃左右至反应结束。
第二步:将反应后混合液过滤,滤液用浓盐酸酸化,抽滤得粗产品。
第三步:粗产品用水洗涤2到3次,干燥称量得固体23.4g。
请回答下列问题:
(1)仪器甲的名称为_________________。
(2)第一步发生反应的化学方程式为____________________________。
(3)第二步中抽滤的优点是____________________________________。
(4)第三步证明洗涤干净的方法是_________________________________;
干燥的最佳方法是________ (填代号)
a.空气中自然风干b.沸水浴上干燥c.直接加热干燥
(5)由以上数据知苯甲酸的产率为_____________。
(6)某学生为测定苯甲酸的电离平衡常数设计实验如下:常温下,将a mol苯甲酸和b mol KOH混合加水形成2L溶液,测得溶液的pH=7,请用含a、b的代数式表示出苯甲酸的Ka=____________,该溶液中的离子浓度大小关系为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com