
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性如图甲可通过观察________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________________________,H2O2在二氧化锰催化作用下发生反应的化学方程式为____________________________________。
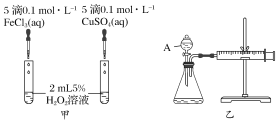
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________。
【答案】反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 ![]() 分液漏斗 收集40 mL气体所需要的时间
分液漏斗 收集40 mL气体所需要的时间
【解析】
首先明确实验目的:比较Fe3+和Cu2+对H2O2分解的催化效果;
(1)图甲:两试管中盛有等体积、等浓度的H2O2,分别滴入氯化铁、硫酸铜溶液,通过产生气泡的快慢即可比较Fe3+和Cu2+对H2O2分解的催化效果(保持其他条件相同,只改变催化剂);在探究Fe3+和Cu2+对H2O2分解的催化效果时必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理;
(2)“收集40 mL气体所需要的时间”即通过计算分别用Fe3+、Cu2+催化时生成O2的速率,来定量比较Fe3+和Cu2+对H2O2分解的催化效果;
(1)该反应中产生气体,所以可根据生成气泡的快慢判断;氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰;双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为![]() ,
,
因此,本题正确答案是:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;![]() ;
;
(2) 由图可以知道,A为分液漏斗;定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生40 mL的气体所需的时间来比较。产生40 mL的气体所需的时间越短,则催化效果越好,
因此,本题正确答案是:分液漏斗;收集40mL气体所需要的时间。


科目:高中化学 来源: 题型:
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
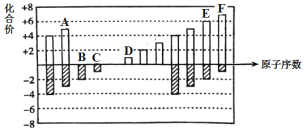
(1)元素F在周期表中的位置是 ______。
(2)元素C、D、E原子半径由大到小的顺序是 ______(填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____(用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______、__(写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 _____(填“能”或“不能”), 若能则写出反应的化学方程式 ______。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ![]() 2AB2(g)。可以作为达到平衡状态的标志是 ______。
2AB2(g)。可以作为达到平衡状态的标志是 ______。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于对各有机物的说法正确的是
A.苯分子中的所有原子均在同一平面上
B.甲烷能使酸性KMnO4溶液褪色
C.乙醇能使紫色石蕊试液变红
D.蛋白质只含有C、H、O三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应最符合绿色化学原子经济性要求的是( )
A. 乙烯聚合为聚乙烯高分子材料B. 甲烷与氯气制备一氯甲烷
C. 以铜和浓硝酸为原料生产硝酸铜D. 用SiO2制备高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(结构简式为![]() )有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
)有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
A. ②③④⑤ B. ①②⑤⑥ C. ②③④⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向氨水中不断通入CO2,随着CO2的增加,![]() 不断减小
不断减小
B. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H>0,△S<0
D. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
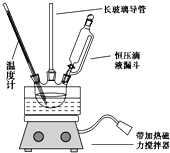
①组装如图反应装置。配制混酸,取100mL烧杯,用20mL浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知:i.![]() +HNO3(浓)
+HNO3(浓) +H2O
+H2O
![]() +HNO3(浓)
+HNO3(浓)
 +H2O
+H2O
ii可能用到的有关数据列表如下:

(1)配制混酸应在烧杯中先加入___________。
(2)恒压滴液漏斗的优点是_____________。
(3)实验装置中长玻璃管可用_______代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为_________。
(5)为了得到更纯净的硝基苯,还需先向液体中加入___(填化学式)除去水,然后采取的最佳实验操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应符合“绿色化学”理念的是
A. 制CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B. 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
C. 制CuSO4:2Cu+O2![]() 2CuO; Cu+H2SO4(稀)═CuSO4+H2O
2CuO; Cu+H2SO4(稀)═CuSO4+H2O
D. 制Cu(NO3)2:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com