
【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.

【答案】 Q1 > 0 K3= ![]() Q3= Q1﹣Q2 吸 DF 加催化剂或加压 降低温度
Q3= Q1﹣Q2 吸 DF 加催化剂或加压 降低温度
【解析】(1)由表中数据可知,温度升高K1增大,所以反应①正向为吸热反应,Q1>0。
(2)根据盖斯定律,①-②可得:③H2(g)+CO2(g)CO(g)+H2O(g) △H=Q3,所以Q3=Q1-Q2,则:K3=![]() =
=![]() ;700K时K3=
;700K时K3=![]() =
=![]() ,900K时K3=
,900K时K3=![]() =
=![]() ,所以升温K3增大,反应③正向为吸热反应。
,所以升温K3增大,反应③正向为吸热反应。
(3)反应③左右两边气体分子数相等,所以缩小容器体积或扩大容器的体积都不影响平衡移动,故A、B都错误;反应③正向为吸热反应,所以降低温度会使平衡左移,升高温度会使平衡右移,故C错误、D正确;催化剂不影响化学平衡,故E错误;CO是生成物,所以减少CO的量平衡会右移,故F正确。综上,选DF。
(4)由图像可知,甲中t2时刻反应速率增大,正逆反应速率仍相等,平衡不移动,故可能使用了催化剂,又根据该反应左右两边气体分子数相等,则增大压强平衡不移动,所以图甲中t2时刻改变的条件可能是:增大压强或加入催化剂;图乙t2时刻CO2浓度增大,CO浓度减小,应该是平衡逆向移动,又因为CO2浓度和CO浓度都没有发生突变,所以不会是人为改变了CO2和CO的浓度,可能是降低了温度使平衡逆向移动的。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓) ![]() CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
(1)A的化学式 , 上述反应中浓硫酸体现了(性质).
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,被还原的硫酸为mol,生成的A气体在标准状况下体积为L (假设气体全部逸出).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是:
A. 将铜丝插入稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+H2O
===Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe===2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Ca2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g.
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl﹣_____,
(2)由第二份进行的实验可知混合物中应含_____离子,其物质的量浓度为_____.
(3)由第三份进行的实验可知12.54g 沉淀的成份为_____.请计算形成该沉淀的原混合物中各离子的物质的量_____.
(4)综合上述实验,你认为以下结论正确的是_____
A.该混合物中一定含有K+、NH4+、CO32﹣、SO42﹣,可能含有Cl﹣,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32﹣、SO42﹣,可能含有Ca2+、K+、Cl﹣
C.该混合物中一定含有NH4+、CO32﹣、SO42﹣,可能含有K+、Cl﹣
D.该混合物中一定含有NH4+、SO42﹣,可能含有Ca2+、K+、Cl﹣.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示.
(1)物质X:CH3CH=CHCH3可表示为![]()
X可以与溴水反应,该反应的化学方程式是_________________________;
X可以发生加聚反应,其产物分子的结构简式是______________________.
(2)一种有机物Y的键线式如图所示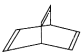
①Y的分子式为___________;
②有机物Z是Y的同分异构体,且属于芳香族化合物,则Z的结构简式是______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项决定于原子结构的哪一部分:①质子数,②中子数,③原子的最外层电子数。(以下各项选择序号填空)
(1)元素的种类取决于____________;
(2)原子的质量数主要由______________决定;
(3)元素的化学性质主要由____________决定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列方程式
①_____KI+_______KIO3+______H2SO4=______I2+_______K2SO4+_______H2O
②_____MnO4-+______H++______Cl-=_____Mn2++______Cl2↑+______H2O
③______P4+______KOH+______H2O=_____K3PO4+______PH3
(2)已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O和未知物X。写出该反应的化学方程式:__________________________________________________。
(3)据报道,日常生活中,将洁厕液与84消毒液混合使用会发生中毒的事故。
①84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:__________;若将84消毒液长期露置于空气中,溶液中的主要成分将变为__________(填化学式)。
②洁厕灵的主要成分是HCl。洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com