

| c(OH-)?c(H+) |
| c(NH3?H2O) |
| c(OH-)?c(H+) |
| c(NH3?H2O) |
| 10-7×5×10-3 |
| 0.5a-5×10-3 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |


科目:高中化学 来源: 题型:
| A、0.250 mol |
| B、0.125 mol |
| C、0.100 mol |
| D、0.080 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
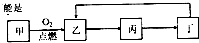 甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )
甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )| A、Fe | B、Si | C、Al | D、S |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )| A、A电源的负极 |
| B、阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液的pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L时有0.1molCr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2CH3 |
| B、CH3CH(CH3)CH3 |
| C、(CH3)3CCH2CH3 |
| D、CH(CH3)2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com