
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述正确的是
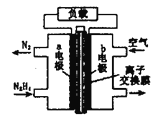
A. b极发生氧化反应
B. a极的反应式为N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电子从a极经过负载流向b极,再经溶液流回a极
D. 其中的离子交换膜需选用阳离子交换膜
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向某 NaOH 溶液中通入 CO2 气体后得到溶液 M,因 CO2 通入的量不同, 溶液 M 的组成也不同,若向溶液 M 中逐滴加入盐酸,产生的气体体积 V(CO2)与加入盐酸的体积 V(HCl)的关系如图所示。则下列分析与判断 不正确的是(不计CO2溶解)
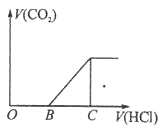
A. 若 OB=0,则形成溶液的过程中所发生反应的离子方程式为OH-+CO2=HCO3-
B. 若 OB=BC,则溶液 M 为Na2CO3 溶液
C. 若 OB>BC,则溶液 M 中大量存在的阴离子为 CO32-和HCO3-
D. 若 3OB=BC,则溶液 M 中 c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(2)CaC2中C22﹣与O22+互为等电子体,O22+的电子式可表示为________。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为______(填元素符号)。
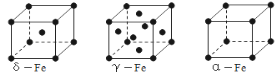
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于平衡膳食宝塔的认识中,正确的是
A.塔底的食物最重要
B.塔顶的食物最重要
C.膳食宝塔所列食物摄入量对任何人都是最佳摄入量
D.膳食宝塔所列食物摄入量是每人每日的建议摄入量,具体到不同的个体要根据自身的情况而调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X能实现转化:有机物X→葡萄糖→有机物Y→乙醛。下列判断中一定错误的是
A. X可以是淀粉或纤维素
B. Y与 CH3OCH3是同分异构体
C. Y可以用于消除少量钠
D. Y→乙醛属于还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中序号分别代表某一元素![]() 请回答下列问题.
请回答下列问题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
| ||||
3 |
|
|
|
|
|
|
![]() 中,最活泼的金属元素是 ______(写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______.
中,最活泼的金属元素是 ______(写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______.
![]() 、
、![]() 的简单离子,其半径更大的是 ______ (写离子符号).
的简单离子,其半径更大的是 ______ (写离子符号).
![]() 、
、![]() 的气态氢化物,更稳定的是 ______ (填化学式).
的气态氢化物,更稳定的是 ______ (填化学式).
![]() 元素的非金属性:
元素的非金属性:![]() ______
______ ![]() 填“
填“![]() ”或“
”或“![]() ”).
”).
![]() 的最高价氧化物的水化物中:碱性最强的是 ______ (填化学式),酸性最强的是 _____ (填化学式); 酸性最强的物质与
的最高价氧化物的水化物中:碱性最强的是 ______ (填化学式),酸性最强的是 _____ (填化学式); 酸性最强的物质与![]() 的最高价氧化物对应的水化物反应的离子方程式为 ______________________________ .
的最高价氧化物对应的水化物反应的离子方程式为 ______________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断合理的是( )
A. 某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42-
B. 单质![]() 氧化物
氧化物![]() 酸或碱
酸或碱![]() 盐,能按照上述转化关系直接转化的可以是硫元素
盐,能按照上述转化关系直接转化的可以是硫元素
C. 浓硫酸有强氧化性,常温下能与Cu发生剧烈反应
D. 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com